voir le Quiz : calcul de pH
un autre Quiz: révisions bac
|
|
|
|
la réaction avec l'eau est partielle
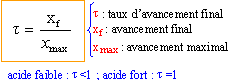
deux espèces sont dites conjuguées si:
il y a coexistence de l'acide et de la base conjuguée en équilibre chimique.
Les concentrations des éspèces sont liées par la relation :
Ka= [base conjuguée]*[H3O+] / [acide]
qui peut s'écrire
pH=pKa+log([base conjuguée] /[acide] )
pKa = -log Ka
Ka = 10-pKa
c' est l'acide conjugué de la base HO-
c'est la base conjuguée de l'acide H3O+
Comment comparer la force de 2 acides faibles ayant même concentration ?
le plus fort donne une solution de pH le plus faible
ou bien
l'acide est d'autant plus fort que son pKa est petit ( ou que son Ka est grand)
Comment comparer la force de 2 bases faibles ayant même concentration ?
la plus forte donne une solution de pH le plus grand
ou bien
la base est d'autant plus forte que son pKa est grand ( ou que son Ka est petit)
un indicateur coloré est constitué par un couple acide base dont les espèces conjuguées ont des teintes différentes.
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
De nombreuses eaux naturelles sont gazeuses car elles contiennent du dioxyde de carbone dissous. Les équilibres sont ( voir ci contre)
|
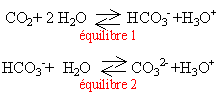 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
vrai le pH de ces eaux est voisin de 7 et le pKa du couple cité est égal à 10,4. En dessous de cette valeur, l'acide HCO3- prédomine. vrai l'acide citrique est plus fort que CO2 ; il réagit sur la base HCO3- en donnant du CO2 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On dispose de deux solutions S1 et S2 d'acide de concentration C. On dilue ensuite 100 fois ces solutions. On mesure le pH avant et après dilution.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
faux S1 est un acide fort: en diluant 100 fois cette solution le pH augmente de 2 unités vrai la relation pH=-log(c) est vérifiée pour S1. vrai à très forte dilution le pH de ces deux solutions se rapproche de 7. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On dissout du fluorure d'ammonium dans de l'eau. Les ions fluorure et ammonium se dispersent totalement dans l'eau. vrai ou faux
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
vrai l' acide le plus fort NH4+ et la base la plus forte OH- sont mis en présence, et l'écart des pKa est voisin de 4,8 ; la réaction entre ces ions est totale. faux la réaction précédente conduit à la formation de NH3, une base et à la disparition d'une partie des ions ammonium. Le pH augmente donc. Or à pH lus élevé , la base F- conjuguée de l'acide HF prédomine de plus en plus. faux on obtient une solution telle que les concentrations de l'ion ammonium et de l'ammoniaque NH3 , la base conjuguée sont différentes. Le pH est différent du pKa du couple NH4+ / NH3. (inférieur car l'ion ammonium, l'acide conjugué prédomine)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Dans le cas d'un acide fort la réaction avec l'eau est totale et le pH de la solution vérifie la relation pH = - lg c. Ici la concentration est de 10-3 la relation n'est pas vérifiée puisque pH =3,7 . L'acide benzoïque est bien un acide faible. . La méthylamine est bien une base car son pH est supérieur à 7 mais c'est une base faible : dans le cas d'une base forte la réaction avec l'eau est totale et le pH d'une solution de monobase forte vérifie la relation pH = 14 + lg c . Or ici pour 10-2 mol.L-1 le pH est égal à 11,3 au lieu de 12 donc la méthylamine est une base faible . |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On prépare une solution aqueuse en dissolvant 0,2 mole de monométhylamine par litre de solution ; la mesure du pH donne la valeur 12 à 25°C.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||