Savon, parfum, synthèse et utilisation. Bac
Métropole 09 /2025.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| ... |
.
.
|
|
.
.
|
..
..
......
...
|
Utilisation de l'acide éthanoïque pour la synthèse de l'éthanoate de linalyle. Q1.
Représenter la formule topologique de l’éthanoate de linalyle, puis
entourer le groupe caractéristique de cette molécule et nommer la
famille fonctionnelle correspondante.
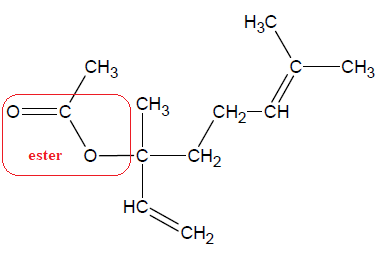
L’éthanoate de linalyle est synthétisé en faisant réagir du linalol avec de l’acide éthanoïque. L’équation de la
réaction modélisant cette transformation chimique, appelée estérification, est :
C 2H 4O 2(ℓ) + C 10H 18O(ℓ) = C 12H 20O 2(ℓ) + H 2O(ℓ)
Cette synthèse est une transformation chimique lente et non totale. On
souhaite étudier l’évolution temporelle de l’avancement, noté x, de
cette réaction. Pour cela, on titre la quantité de matière d’acide
éthanoïque restant dans le milieu réactionnel, par une solution aqueuse
d’hydroxyde de sodium à différentes dates t au cours de la
transformation.
Q2. Écrire l’équation de la réaction support du titrage.
C2H4O2(aq) +HO-aq-->C2H3O2-(aq)+H2O(l).
Préalablement à cette expérience, on cherche à vérifier le caractère
total de la transformation support du titrage. Pour cela, on introduit
un volume V B = 5,0 mL d’une solution aqueuse d’hydroxyde de sodium de concentration c B = 1,0×10 –2 mol·L –1 dans un volume V A
= 50,0 mL d’une solution d’acide éthanoïque. Dans ces conditions,
l’acide éthanoïque est en excès. Le pH du mélange à 25°C est de 4,6.
Q3. Calculer, en utilisant la valeur de Ke, la concentration finale en quantité de matière en ions hydroxyde,
notée [OH –] f, dans ce mélange de volume V A + V B. En déduire que la quantité de matière n f(OH –) à l’état final dans le mélange est d’environ 2,2×10 –11 mol.
[OH–]f [H3O+]f,=10-14 , [OH–]f =10-14 / 10-4,6 ~4,0 10-10 mol / L.
nf(OH–)= 4,0 10-10 x(55 10-3)=2,2 10-11 mol.
Q4. Comparer cette valeur à celle de la quantité d’ions hydroxyde introduite initialement puis commenter.
V B C B =5,0 10 -3 x0,010 =5,0 10 -5 mol.
nf(OH–) << 5,0 10-5 : la transformation support du titrage est totale.
On admet qu’on peut généraliser ce résultat à tout moment du titrage.
On effectue expérimentalement le suivi temporel de l’estérification.
Les résultats obtenus permettent de représenter l’évolution de la
quantité de matière d’éthanoate de linalyle formé, notée n ester, au cours du temps
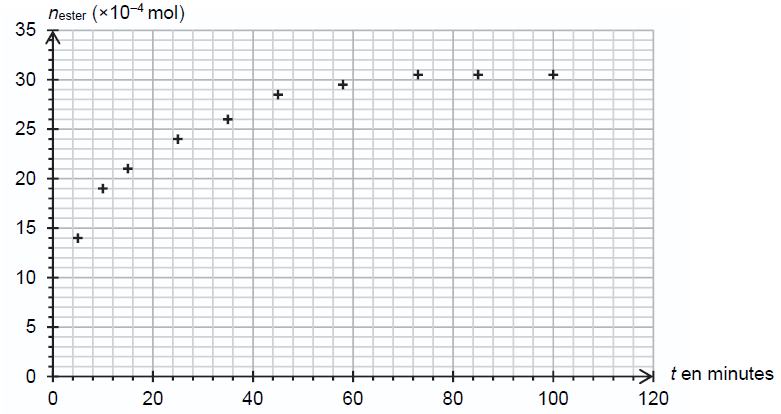 Q5.
Q5. Exprimer la vitesse volumique d’apparition de l’éthanoate de linalyle, notée v ester, en fonction du volume V du milieu réactionnel et de n ester.
v ester = 1 / V dn ester / dt.
Q6. Décrire, en justifiant, l’évolution de la vitesse volumique d’apparition de l’éthanoate de linalyle au cours du
temps. Proposer un facteur cinétique à l’origine de cette évolution.
Le coefficient directeur de la tangente à la courbe correspond à dnester / dt.
Au cours du temps, les tangentes sont de moins en moins inclinées par rapport à l'horizontale : dnester / dt diminue.
vester diminue : la concentration des réactifs diminue au cours du temps ; la concentration est un facteur cinétique.
Le rendement de cette synthèse est faible. Afin de l’améliorer, il est possible d’envisager un montage
permettant l’élimination de l’eau produite au cours de la réaction. Le
système étant homogène, on admet que la constante d’équilibre K de la
réaction d’estérification s’écrit :
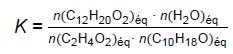
où n(X) éq représente la quantité de matière de l’espèce X dans le milieu réactionnel à l’équilibre chimique.
Q7. Expliquer en quoi l’élimination de l’eau au cours de la synthèse permet d’améliorer le rendement.
En éliminant l'eau au fur et à mesure de sa formation, (Q r=0 < K); l'état d'équilibre ne sera jamais atteint. La réaction se déroule dans le sens direct et sera totale.
2. Utilisation de l’anhydride éthanoïque pour la synthèse de l’éthanoate de linalyle.
L’éthanoate de linalyle peut également être synthétisé à partir
d’anhydride éthanoïque et de linalol. Cette transformation est totale
et peut être modélisée par l’équation de réaction suivante :
C4H6O3(ℓ) + C10H18O(ℓ) --> C12H20O2(ℓ) + C2H4O2(ℓ)
On réalise la synthèse de l’éthanoate de linalyle en suivant les étapes du protocole décrites ci-dessous :
Étape n°1 :
- à la date t = 0, introduire 10 mL de linalol et 10 mL d’anhydride éthanoïque dans un ballon sec ;
- agiter et chauffer le mélange à l’aide d’un montage à reflux pendant une durée de 30 min.
Étape n°2 :
- verser doucement 30 mL d’eau distillée dans le ballon, par le sommet
du réfrigérant. L’excès d’anhydride éthanoïque est alors totalement
transformé en acide éthanoïque ;
- transvaser le contenu du ballon refroidi dans une ampoule à décanter et laisser décanter le mélange.
Étape n°3 :
- récupérer la phase organique et la traiter pour éliminer les impuretés restantes.
Q8. Indiquer, en
justifiant, la nature et la position de la phase dans laquelle se
trouve l’éthanoate de linalyle à la fin de l’étape n°2.
La phase acqueuse la plus dense occupe la partie inférieure. La phase organique contenant l'ester occupe la partie supérieure.
Pour vérifier la composition de la phase organique, on l’analyse à
l’aide d’une chromatographie sur couche mince. Après révélation à
l’aide d’une solution de permanganate de potassium, on obtient le
chromatogramme suivant.
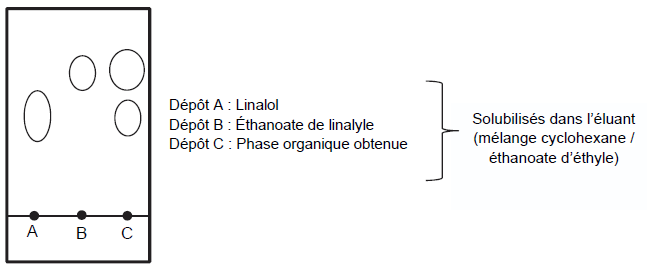
Q9. Identifier, en justifiant, les espèces présentes dans la phase organique. Commenter.
On identifie le linalol et l'éthanoate de linalyse par comparaison des rapports frontaux.
La synthèse est réalisée une seconde fois en conservant l’ensemble des
paramètres expérimentaux (température, durée de l’expérience, quantités
de matière initiales), mais en ajoutant une très faible quantité d’un
acide, l’APTS (acide paratoluènesulfonique), dans le ballon lors de
l’étape 1. Le volume de la phase organique alors recueillie est de 9,4
mL et le chromatogramme obtenu est reproduit ci-dessous.
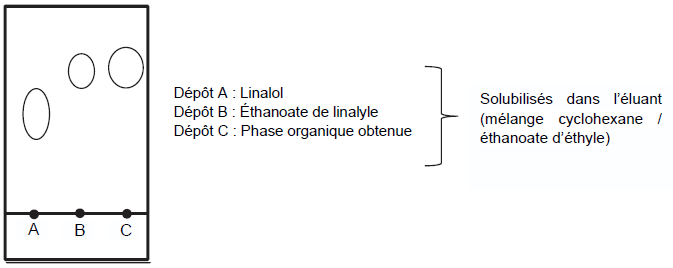
Q10. Déterminer l’intérêt de l’ajout d’APTS dans le milieu réactionnel.
L'APTS joue le rôle de catalyseur.
Q11. Après avoir montré que le linalol est le réactif limitant dans la transformation chimique étudiée, calculer le
rendement de la synthèse avec ajout d’APTS.
masse (g) = volume (mL) fois masse volumique ( g / mL).
m(linalol ) =10 x0,87 = 8,7 g.
m(linalol) / M(linalol) = 8,7 / 154 =0,056 mol.
m(anhydride éthanoïque) = 10 x 1,08 = 10,8 g.
M(anhydride éthanoïque) = 102 g/mol.
10,8 / 102 =0,106 mol. ( en excès).
n(ester) théorique = 0,056 mol.
Masse réelle d'ester : 9,4 x 0,89 = 8,37 g.
nester (réelle) =8,37 / M(ester) = 8,37 / 196= 0,0426 mol.
Rendement = 0,0426 / 0,056 ~0,76 (76 %).
|
...
= =
|
....
|
3. Synthèse et pouvoir moussant d’un savon - Dureté d’une eau
Données :
La dureté de l’eau ou titre hydrotimétrique (TH) est essentiellement due à la présence d’ions calcium
Ca2+ et magnésium Mg2+. Elle s’exprime en degré français (°f) et s’obtient par la relation :
TH = 104·[X2+]
où [X2+] représente la somme des concentrations en quantité de matière des ions calcium et magnésium exprimées en mol·L–1 .
Formation d’un savon
L’une des principales applications de l’hydrolyse basique d’un ester
est la synthèse des savons. L’hydrolyse basique d’un ester est une
transformation chimique, lente et totale, au cours de laquelle un
alcool et un ion carboxylate sont obtenus par réaction entre un ester
et un ion hydroxyde OH–. Le mécanisme de cette réaction se décompose en trois étapes présentées ci-dessous, où R1 et R2 représentent des chaînes carbonées :
Q12. Identifier, en
justifiant à l’aide des électronégativités, le site accepteur
d’électrons (site électrophile) de la molécule d’ester.
L'atome d'oxygène étant plus électronégatif que l'atome de carbone, le carbone du groupe COO- est déficitaire en électrons : c'est le site accepteur.
Q13. Recopier la première étape du mécanisme sur la copie, puis la compléter à l’aide de flèches courbes.
Q14. Indiquer, pour chacune des trois étapes, le type de réaction mise en jeu.
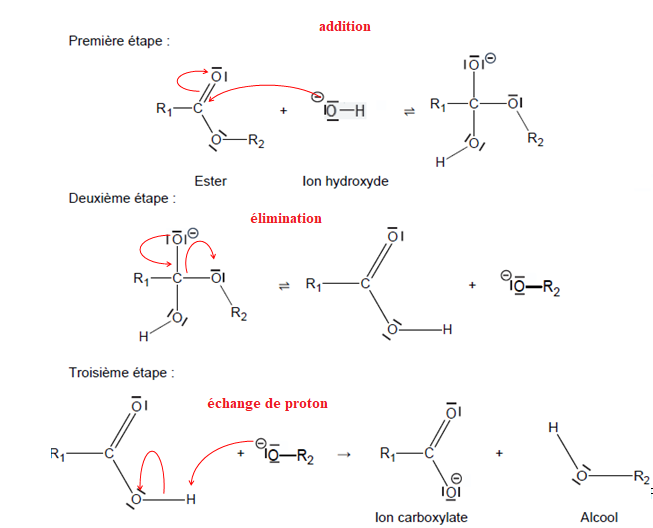
Dureté d’une eau et pouvoir moussant d’un savon
En présence d’ions calcium Ca2+ et magnésium Mg2+,
les ions carboxylate présents dans un savon forment un précipité
entraînant la diminution de son pouvoir moussant. La dureté de l’eau
influe donc sur l’efficacité d’un savon.
On détermine la dureté d’une eau à l’aide d’un titrage colorimétrique des ions Ca2+ et Mg2+, notés indifféremment X2+, suivant le protocole expérimental décrit ci-dessous :
- introduire un volume Veau = 50,00 mL d’eau à étudier dans un erlenmeyer (incertitude-type associée : u(Veau) = 0,03 mL) ;
- ajouter 20 mL de solution tampon de pH = 10 et quelques gouttes d’un indicateur coloré ;
- doser la solution contenue dans l’erlenmeyer, par une solution aqueuse d’EDTA disodique (2 Na+(aq) ; H2Y2–(aq)) de concentration c = 5,00×10–3 mol·L–1 (incertitude-type associée : u(c) = 0,06×10–3 mol·L–1).
Le volume à l’équivalence VE = 17,6 mL est repéré par le changement de couleur de l’indicateur coloré.
L’incertitude-type associée à ce volume est : u(VE) = 0,1 mL.
Dans ces conditions, l’EDTA réagit avec les ions calcium et magnésium
contenus dans l’eau selon l’équation support de titrage suivante :
X2+(aq) + H2Y2–(aq) → XY2–(aq) + 2 H+(aq)
Q15. Établir que la relation suivante est vérifiée à l’équivalence du titrage :
[X2+] = c · VE / Veau.
A l'équivalence n(X2+) = n( H2Y2–).
[X2+] Veau = c VE ; [X2+] = c · VE / Veau.
[X2+] =5,00 10-3 x17,6 / 50,00 =1,76 10-3 mol / L.
Q16. Calculer
la valeur du titre hydrotimétrique TH de l’eau étudiée, puis déterminer
l’incertitude-type u(TH) associée à cette mesure.
TH = 104 [X2+] =17,6.
u(TH)=TH ( (u(VE) / VE)2 +(u(c) / c)2 +(u(Veau/ Veau)2)½.
u(TH)=17,6 ( (0,1 / 17,6)2 +(0,06) / 5)2 +(0,03/ 50)2)½=17,6(3,22 10-5 +1,44 10-4 +3,6 10-7)½ ~0,2.
u(TH = 17,6 ±0,2 °f, eau moyennement dure.
17. Comparer, en
justifiant, le pouvoir moussant d’un savon dans l’eau titrée avec celui
dans une eau dont la dureté serait de 30 °f.
30°f correspond à une eau dure.
Le pouvoir moussant du savon est meilleure dans une eau de dureté 17,6 °f que dans une eau de dureté 30 °f.
|
|
|
|