Le carbonate de sodium, de formule Na
2CO
3, entre dans la composition de
nombreuses lessives pour le nettoyage des sols et des murs. Il permet de
« solubiliser » les corps gras, facilitant ainsi l’action des tensioactifs.
Les objectifs de cet exercice sont de :
- mener une étude des propriétés acido-basiques de l’ion carbonate ;
- vérifier que le pourcentage en masse de carbonate de sodium présent
dans une lessive « multi-usages » est bien compris entre 30 et 60 %,
comme annoncé par le fabriquant.
1. Étude des propriétés acido-basiques de l’ion carbonate
Données :
-masse molaire de Na
2CO
3 : 106,0 g·mol
–1 ;
valeurs des pKA à 25 °C des couples acide-base associés à CO
2(aq) : CO
2(aq) / HCO
3
–
(aq) : pKA1 = 6,4 ; HCO
3
–
(aq) / CO
3
2–(aq) : pKA2 = 10,3 ;
diagramme de distribution en fonction du pH des différentes espèces acide-base des couples associés
à CO
2(aq) :
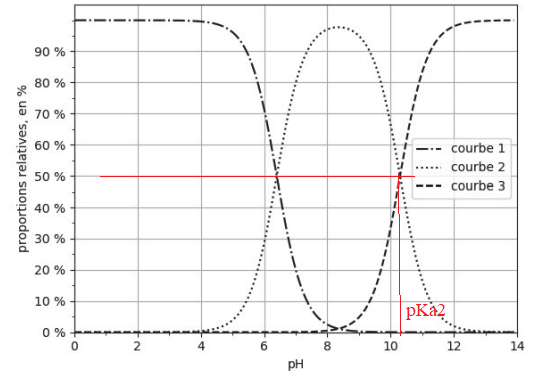 Q1.
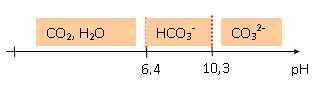
Q1. Représenter le diagramme de prédominance des espèces acide-base des couples associés à CO
2(aq).
 Q2.
Q2. Identifier, en justifiant, les espèces chimiques associées à chacune des courbes 1, 2 et 3 de la figure
A pH < 6,4 CO
2,H
2O prédomine : courbe 1.
A pH compris entre 6,4 et 10,3, HCO
3- prédomine : courbe 2.
A pH > 10,4 CO
32- prédomine : courbe 3.
.
Q3. Expliquer, en justifiant, comment retrouver la valeur du pKA2 associée au couple HCO
3
–
(aq) / CO
3
2–(aq) à
l’aide de la figure.
A pH= pKa2 =10,4, [
HCO3
–
(aq)] = [CO3
2–(aq)]
.
Q4. Écrire l’équation de réaction modélisant la transformation mettant en jeu l’ion carbonate CO
3
2–(aq) et l’eau.
Justifier le caractère basique des ions carbonate dans l’eau.
CO3
2–(aq) +H2O(l) -->HCO3
–
(aq) +HO-aq.
L'ion carbonate constitue la base du couple HCO3
–
(aq) / CO3
2–(aq)