Le procédé d’anodisation est un procédé de traitement de surface utilisé
le plus souvent sur des pièces en aluminium.
L’aluminium Al(s) est transformé à la surface des pièces en alumine
Al
2O
3(s) au cours d’une électrolyse. Cette couche d’alumine permet ainsi
de protéger la pièce de la corrosion et rend possible l’imprégnation d’un
colorant.
On s’intéresse, dans cet exercice, au processus d’anodisation d’une pièce
de jeu d’échecs en aluminium, ainsi qu’à sa coloration.
masse molaire de l’alumine Al
2O
3(s) : Malumine = 102 g·mol
–1 ;
masse volumique de l’eau :
reau = 1,0 kg·L
–1 ;
couple oxydant/réducteur associé à l’alumine : Al
2O
3(s) / Al(s) ;
couples oxydant/réducteur de l’eau : H
+(aq) / H
2(g) et O
2(g) / H
2O(ℓ) ;
charge d’une mole d’électrons : F = 96 500 C·mol
–1 ;
on appelle anode l’électrode siège d’une oxydation et cathode l’électrode siège d’une réduction.
1. Préparation du bain d’anodisation sulfurique
Lors de son anodisation, une pièce de jeu d’échecs est plongée dans une solution aqueuse d’acide sulfurique
à 18 °C. Cette solution est aussi appelée « bain d’anodisation » sulfurique.
Q1. Préciser, en justifiant, les précautions à prendre lors de la manipulation de l’acide sulfurique.
Liquide corrosif, provoque des brûlures : port de blouse, gants et lunettes de protection.
Q2. Déterminer la masse d’acide sulfurique commercial à peser pour préparer 500 mL d’une solution aqueuse
d’acide sulfurique de concentration 180 g·L
–1.
Densité 1,83 ; titre massique 98 % ; masse molaire 98,1 g / mol.
Masse d'acide dans un litre : 1,83 x0,98 = 1,7934 kg.
Masse d'acide dans la solution préparée : 90 g.
Masse de solution commerciale à peser : 90 g.
2. Anodisation de la pièce de jeu d’échecs
La pièce de jeu d’échecs, après avoir été nettoyée de manière appropriée,
est immergée dans le bain d’anodisation où se déroule l’électrolyse. Elle
constitue alors l’anode de l’électrolyse, la cathode étant une électrode en
graphite inerte.
Q3. Indiquer si la transformation qui se déroule lors d’une électrolyse est
une transformation d’oxydoréduction spontanée ou forcée.
Transformation forcée nécessitant un apport d'énergie électrique.
Q4. Écrire la demi-équation électronique modélisant la transformation
électrochimique de l’aluminium en alumine, puis justifier que la pièce de
jeu d’échecs à traiter constitue l’anode de l’électrolyse.
2Al(s) + 3H
2O -->Al
2O
3(s) +6H
+aq + 6e
-.
L'aluminium est le réducteur qui s'oxyde ; il constitue l'anode de l'électrolyse.
La cathode est le siège de la réduction de l’eau.
Q5. Écrire la demi-équation électronique modélisant la réduction de l’eau, puis justifier l’observation d’un
dégagement gazeux au niveau de l’électrode en graphite.
2H+aq +2e- --> H2 (g).
Q6. En déduire que l’équation de réaction modélisant cette électrolyse s’écrit :
2 Al(s) + 3H
2O(l) → Aℓ
2O
3(s) + 3 H
2(g)
2Al(s) + 3H2O -->Al2O3(s) +6H+aq + 6e-.
3fois { 2H+aq +2e- --> H2 (g)}.
Ajouter :2Al(s) + 3H2O +6H+aq +6e- ->Al2O3(s) +6H+aq + 6e-+3H2 (g).
Simplifier : 2 Al(s) + 3H2O(l) → Aℓ2O3(s) + 3 H2(g)
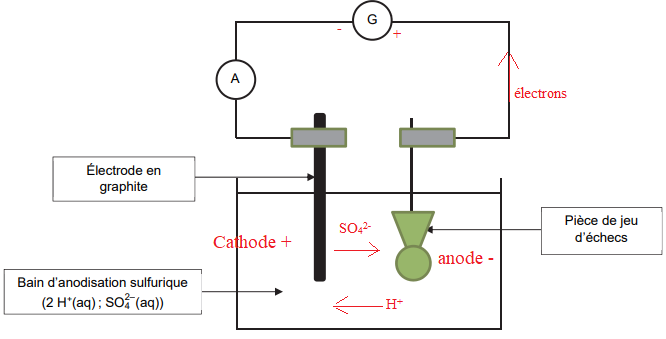
Q7. Indiquer, sur le schéma du montage de l’électrolyse :
- le sens de déplacement des électrons ;
- les bornes + et – du générateur ;
- le sens de déplacement des cations H
+(aq) et des anions SO
4
2– (aq) dans la solution entre les
électrodes.
Durant les 40 minutes de l’électrolyse, le générateur débite un courant d’intensité constante et égale à 0,55 A.
Q8. Déterminer la masse théorique d’alumine produite sur la pièce de jeu d’échecs au cours de cette
électrolyse.
40 min = 40 x60 s =2400 s.
Q = I t = 0,55 x 2400 =1320 C.
Quantité de matière d'électrons : 1320 / 96500 =0,0137 mol.
Quantité de matière d'alumine : 0,0137 / 6 =0,00228 mol.
Masse d'alumine : 0,00228 x102 =0,23 g.