|
Ester : formiate d'éthyle : concours Eni-Geipi-Polytech 2010. |
|||||||
| .
. |
|||||||
|
|||||||
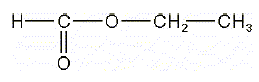 Donner le nom systématique de l’ester E. méthanoate d'éthyle. Pour synthétiser E, on fait réagir entre elles deux molécules : A, qui appartient à la famille des acides carboxyliques et B, à celle des alcools. Ecrire l’équation-bilan de la réaction en faisant apparaitre les formules semi-développées des réactifs et produits. 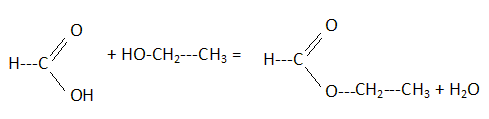 L’expérience est menée en mélangeant nA0 = 0,50 mol de A avec nB0 = 1,00 mol de B, auxquels on additionne quelques gouttes d’acide sulfurique concentré. Le mélange est porté à reflux dans un réacteur fermé, à volume constant. La réaction est athermique. Quel volume de A a-t-on mesuré pour réaliser l’expérience ? ρ(A) = 1,22 g.cm-3 , ρ (B) = 0,79 g.cm-3 . Masse molaire de A : M(A) = 12+2+32 = 46 g/mol masse de A : m = nA0 M(A) = 0,50*46 = 23 g Volume = m / ρ(A) = 23 / 1,22 = 18,86 ~19 mL.
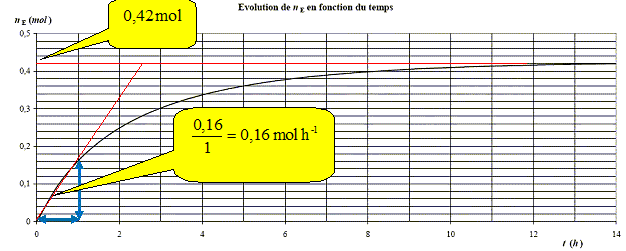
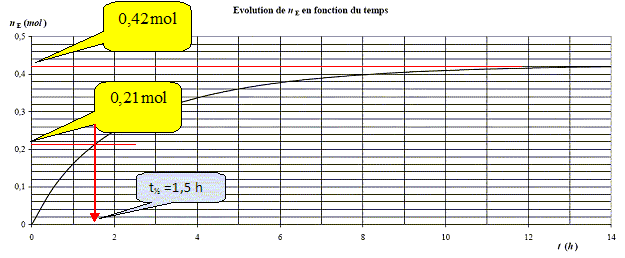
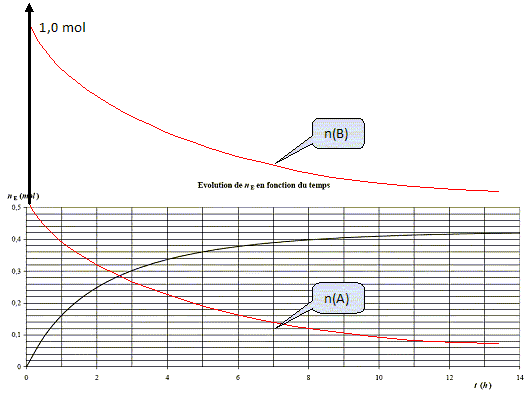
On considère qu’après 14 h
le système n’évolue plus. Déterminer
l’avancement final et le taux d’avancement de la réaction.
Donner
la constante d’équilibre de la réaction.
|
|||||||
| |
|||||||
|
|