|
Pétrochimie, synthèse de l'ammoniac, saponification, concours technicien de l'industrie et des mines 2008. |
||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
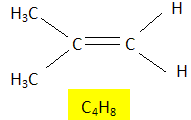
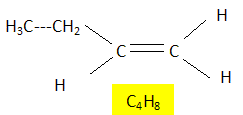
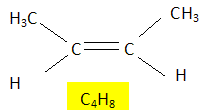
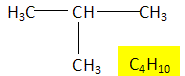
Le tableau ci-dessous donne la composition centésimale massique de composés à 4 atomes de carbone obtenu pa craquage catalytique du gazole.
Donner la formule brute et semi-développée des produits obtenus. voit la colonne 3 du tableau.. Quels sont les produits isomères de constitution. Butane et 2-méthylpropane. 2-méthylpropène, but-1-ène, (Z)- but-2-éne et (E)-but-2-ène. Que peut-on dire du (Z)- but-2-éne et du (E)-but-2-ène. Ce sont deux diastéréoisomères. Comment s'appelle le procédé permettant de séparer le gazole du pétrole ? Le décrire en quelques lignes. La distillation fractionnée. Les constituants les plus volatils se trouvent en tête de colonne ; les composants les plus lourds se situent en queue de colonne.
Faire le bilan des liaisons rompues et reformées.
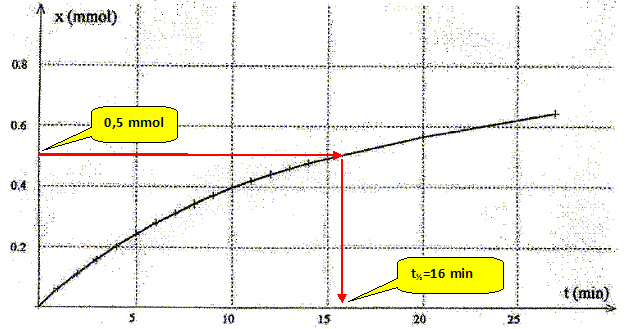
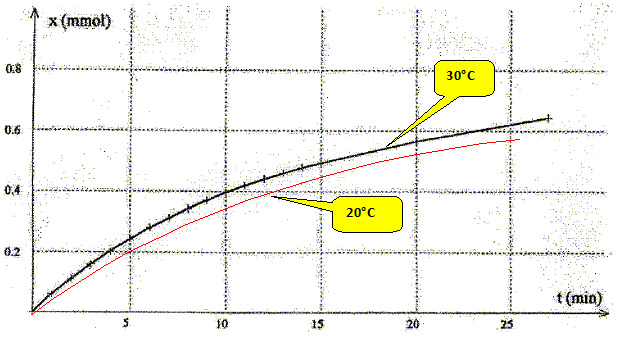
Saponification. préparation des savons. La saponification des esters permet de préparer des savons. On se propose d'tudier la cinétique de la réaction entre léthanoate d'éthyle et une solution de soude. L'équation chilmique associée à la réaction s'écrit : C4H8O2 aq + Na+aq + HO-aq = Na+aq +C2H3O2-aq+ C2H6O aq. A un instant choisi comme origine des dates, on introduit de l'éthanoate d'éthyle dans un becher contenant une solution de soude. On obtient un volume V = 100,0 mL de solution où les concentrations de toutes les espèces chimiques valent c0 = 1,0 10-2 mol/L. La température est maintenue constante à 30 °C. On plonge dans le mélange la sonde d'un conductimètre qui permet de mesurer à chaque instant la conductivité s de la solution. les mesures obtenues permettent de calculer les valeurs de l'avancement x(t) à chaque instant. Le graphe suivant représente l'avancement x(t) en fonction du temps. Donner l'expression de la vitesse volumique de la réaction en précisant les unités. v = 1/V dx/dt ; V volume de la solution en L ; : avancement en mol ; t temps en minutes ; v : vitesse en mol L-1 min -1. Expliquer comment déterminer graphiquement cette vitesse à un instant donné. Evaluer cette vitesse à t=0. Tracer la tangente à la courbe à la date considérée. Déterminer le coefficient directeur de la tangente dx/dt puis diviser par V, volume de la solution. 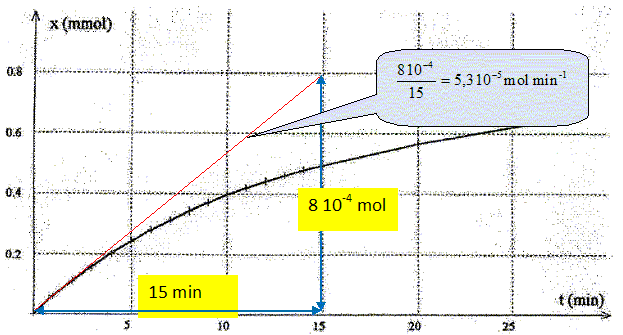 v = 1/0,1 * 5,3 10-5 = 5,3 10-4 mol L-1min-1.
|
||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||
|
|