Généralités.
On donne la formule semi-développée d'un ester, le méthylpropanoate d'éthyle.
Recopier
la formule, entourer le groupe ester.
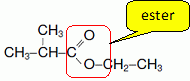
Cet ester est obtenu par réaction entre l’acide méthylpropanoïque et un alcool.
Donner le nom et la formule semi-développée de l’alcool utilisé.
Alcool éthylique ou éthanol CH3-CH2-OH.
Citer deux caractéristiques de la réaction d’estérification.
Lente, limitée par l'hydrolyse de l'ester.
Etude cinétique de la transformation.
Dans toute la suite de l’exercice, l’acide sera noté AH, l’alcool C et l’ester E. On notera nA, nC, et nE les quantités de matière correspondantes à un instant quelconque.
On verse dans un ballon bicol une quantité nA0 = 1,0 mol d’acide AH et une quantité nC0
= 1,0 mol d’alcool C. On ajoute quelques grains de pierre ponce puis on
chauffe à reflux ce mélange réactionnel pendant plusieurs jours. On
dose à intervalles de temps réguliers Dt = 12 h l’acide contenu dans un petit volume prélevé dans le mélange réactionnel.
Les résultats des différents titrages permettent de calculer
l'avancement x à différents instants et de tracer la courbe x = f(t).
À propos du montage.
Quel est le volume d’alcool versé dans le ballon ?
Données : Masse molaire de l’alcool MC = 46 g.mol−1 ; masse volumique de l’alcool : rC = 0,80 g.mL−1.
Masse d'alcool initial : m = MC nC0 =46*1,0 = 46 g.
Volume d'alcool initial : V = m / rC =46/0,80 =57,5 mL ~58 mL.
Indiquer le sens de circulation de l’eau dans le réfrigérant.
Compléter
le schéma du document 3 de la feuille annexe en ajoutant les
élémentsnécessaires à l’utilisation du chauffage à reflux en toute
sécurité.
|
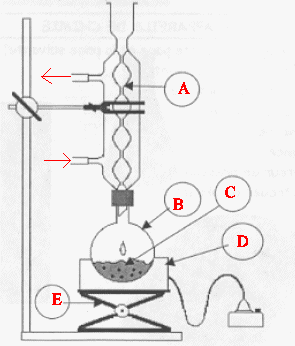
A : réfrigérant à eau ; B : ballon ; C : mélange réactionnel ; D
: chauffe ballon ; E : élévateur à
croisillons.
.
|
Quel est l’intérêt du ballon bicol ?
On peut prélever facilement à intervalle de temps régulier une fraction
du mélange réactionnel dans le but de doser l'acide restant.
Exploitation des résultats.
En utilisant le document 2 de la feuille annexe, déterminer l’avancement final de la transformation.
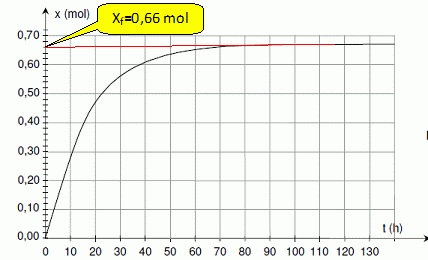
Calculer le taux d’avancement final sachant que l’avancement maximal est xM = 1,0 mol.
t = xf / xM = 0,66 / 1 = 0,66.
Déterminer le temps de demi-réaction. Les constructions nécessaires doivent figurer sur lacourbe du document 2.
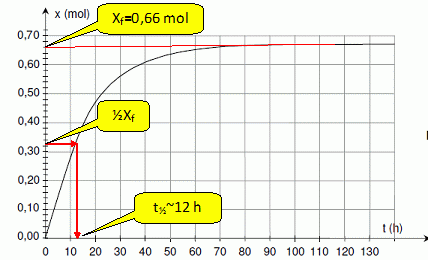
En
traçant les tangentes à la courbe en deux instants différents, indiquer
sans faire de calcul, comment évolue la vitesse volumique de la réaction.
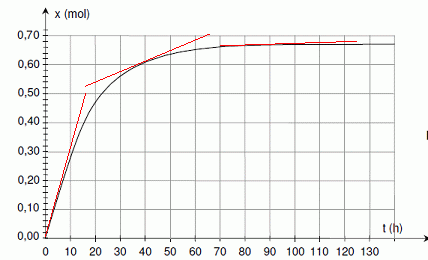
La vitesse de la réaction est proportionnelle à dx/dt. Or le coeficient directeur des tangentes à la courbe est égale à [dx/dt]t.
Les
tangentes sont de moins en moins inclinées par rapport à l'horizontale,
au cours du temps : le coefficient directeur de ces tangentes diminue
au cours du temps.
La vitesse de la réaction diminue donc.
Quel est le facteur cinétique responsable de cette évolution ?
La concentration des réactifs est un facteur cinétique.
Comment peut-on obtenir l’autre courbe ?
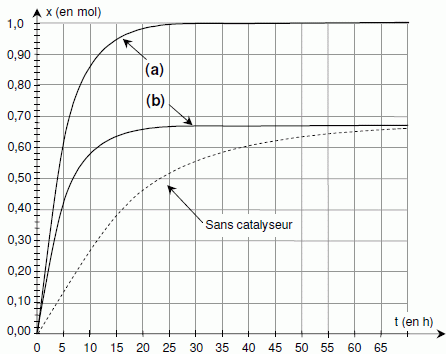
Courbe (b) : l'équilibre est atteint plus rapidement, mais le taux d'avancement final reste inchangé : on utilise un catalyseur.
Courbe (a) : l'équilibre
est atteint plus rapidement et le taux d'avancement final est égal à 1
: on élimine l'un des produits au fur et à mesure de sa formation ou
bien on remplace l'acide par l'anhydride correspondant.
Titrage de l'acide restant.
Toutes
les douze heures, on prélève un volume V = 5,0 mL du mélange
réactionnel qu’on trempe rapidement. On dose ensuite l’échantillon par
une solution d’hydroxyde de sodium (Na+(aq) + HO−(aq)) de concentration cB = 1,0 mol.L−1. Soit VBE le volume d’hydroxyde de sodium versé à l’équivalence.
Écrire l’équation de la réaction de titrage de l’acide AH par une solution aqueuse d’hydroxyde de sodium.
AHaq + HO−(aq) = A-aq + H2O(l).
Rappeler la définition de l’équivalence d’un titrage.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'un des réactifs
est en excès, après l'équivalence, l'autre réactif est en excès.
En déduire la relation entre la quantité nAéch d’acide présent dans l’échantillon et le volume VBE d’hydroxyde de sodium versé. On pourra s’aider d’un tableau d’avancement.
état
|
avancement (mol)
|
AHaq |
+ HO−(aq) |
= A-aq |
+ H2O(l) |
initial
|
0
|
nAéch |
nB
|
0
|
solvant
|
en cours
|
x
|
nAéch-x
|
nB-x
|
x
|
équivalence
|
xmax
|
nAéch-xmax =0
|
nB-xmax=0
cB VBE-xmax=0 |
xmax |
cB VBE-xmax=0 donne xmax = cB VBE ; nAéch-xmax =0 donne nAéch = xmax ; nAéch =cB VBE.
À l’instant t = 36 h, l’équivalence du titrage est obtenue pour un volume VBE = 14,0 mL.
Calculer la quantité d’acide nAéch présent dans l’échantillon prélevé à cet instant.
nAéch =1,0 * 14,0 10-3 = 1,4 10-2 mol.
Le volume initial du mélange réactionnel est VI = 148 mL.
En déduire la quantité nA d’acide restant à cet instant.
1,4 10-2 mol dans un échantillon de 5 mL soit : nA=1,4 10-2 *148/5 =0,41 mol.
|
|
On désire pour terminer, vérifier un point de la courbe x = f(t).
Compléter le tableau d’avancement de la transformation donné.
4.2.
En déduire la relation à l’instant t entre les quantités nA, nA0 et
l'avancement x.ntre les quantités nA, nA0 et l'avancement x.
4.3 Calculer l'avancement x à l’instant t = 36 h et vérifier que le résultat est conforme à celui
donné par la courbe du document 2 en annexe. |





