|
Synthèse
du benzoate de méthyle :
bac S |
|||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||
Ecrire l'équation de la réaction associée à la transformation et donner ses caractéristiques. C6H5COOH + CH3OH = C6H5COOCH3 + H2O. L'estérification est lente, athermique, limitée par l'hydrolyse de l'ester. Quel est le rôle de l'acide sulfurique ? L'acide sulfurique joue le rôle de catalyseur.
Dans
un ballon on introduit 12,2 g d'acide benzoïque, 40 mL de méthanol, 3
mL d'acide sulfurique concentré et quelques grains de pierre ponce. On
réalise un montage à reflux sous la hotte et on chauffe doucement
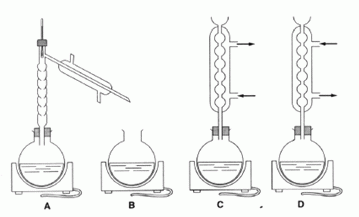
pendant 1 heure. C convient. Montage de chauffage à reflux. D : Chauffage à reflux, mais les branchements de l'eau sont inversés. Pourquoi chauffe t-on ? Quelle est l'utilité du chauffage à reflux ? En chauffant on augmente la vitesse de la réaction. Le chauffage à reflux permet d'augmenter la vitesse de la réaction en travaillant à température modérée. On évite les pertes de matière : les vapeurs se condensent dans le réfrigérant vertical et retombent dans le milieu réactionnel. Déterminer les quantités de matière en méthanol et en acide benzoïque. Méthanol : masse (g) = masse volumique ( g/mL) * volume (mL) = 0,8 *40 = 32 g Quantité de matière (mol) = masse (g) / masse molaire (g/mol) = 32 / 32 = 1 mol. Acide benzoïque : n = m / M = 12,2 / 122 = 0,1 mol. Montrer que l'on utilise un excès de méthanol. Quel est le but recherché ?
Si le méthanol est en défaut : 1-xmax= 0 oit xmax =1. Le méthanol est en excès. En présence de l'excès d'un réactif, on déplace l'équilibre dans le sens direct, formation des produits. Le rendement de la synthèse augmente.
Après refroidissement on verse le contenu du ballon dans une ampoule à décanter contenant 50 mL d'eau distillée froide. On obtient deux phases différentes. Après traitement de la phase contenant l'ester, on récupère une masse m = 10,2 g de benzoate de méthyle. Dessiner l'ampoule à décanter; indiquer la place respective des deux phases et préciser leur contenu. Le méthanol en excès, soluble dans l'eau, constitue une phase homogène avec l'eau, de densité inférieure à 1, proche de 1. Le reste d'acide benzoïque et l'ester insoluble dans l'eau constitue la phase organique de densité supérieure à 1. La phase organique, la plus dense, occupe la partie inférieure de l'ampoule à décanter.  Quelle serait la masse d'ester obtenu si la réaction était totale ? A partir de 0,1 mol d'acide benzoïque, réactif en défaut, on peut espérer obtenir au plus 0,1 mol d'ester soit : mester = n Mester = 0,1*136 = 13,6 g. Calculer le rendement. masse expérimentale d'ester / masse théorique d'ester = 10,2 / 13,6 = 0,75 ( 75 %).
|
|||||||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||||||
|
|