|
L'acide lactique.
Le détartrant à base d'acide lactique est conditionné sous forme
liquide dans un petit flacon. La notice d'utilisation indique su'il
faut verser la totalité de son contenu dans le réservoir de la
cafetière et qu'il faut ajouter de l'eau. On prépare ainsi un volume V
= 0,60 L d'une solution aqueuse d'acide lactique de concentration
molaire en soluté apporté C = 1 mol/L. Après agitation la valeur du pH
est 1,9.
 Ka ( acide lactique / ion lactate) = 1,3 10-4 à 25°C. Ka ( acide lactique / ion lactate) = 1,3 10-4 à 25°C.
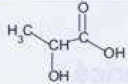
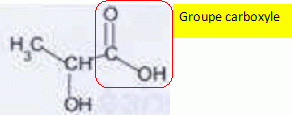
Recopier la formule, entourer et nommer le groupe caractéristique responsable de l'acidité de la molécule.
On note AH l'acide lactique.
Ecrire l'équation de la réaction de l'acide lactique avec l'eau.
AHaq + H2O(l) = A-aq + H3O+aq.
Compléter le tableau descriptif de l'évolution du système.
état
|
avancement (mol)
|
AHaq |
+ H2O(l) |
= A-aq |
+ H3O+aq |
initial
|
0
|
CV
|
solvant
|
0
|
0
|
en cours
|
x
|
CV-x
|
x
|
x
|
final
|
xéq
|
CV-xéq |
xéq |
xéq |
Donner l'expression de l'avancement final en fonction du pH et du volume V.
xéq=[H3O+aq]éq V = 10-pH V.
Calculer le taux d'avancement final. La transformation est-elle totale ? Justifier.
t = xéq/ xmax avec xmax = CV ; t = 10-pH / C =10-1,9 =0,013 ~0,01.
Le taux d'avancement final étant inférieur à 1, la transformation est limitée.
|
Donner l'expression de la constante d'acidité Ka du couple acide lactique / ion lactate.
Ka = [A-aq]éq [H3O+aq]éq / [AHaq]éq.
|
Calculer le rapport : [A-aq]éq / [AHaq]éq.
[A-aq]éq / [AHaq]éq = Ka / [H3O+aq]éq = 1,3 10-4 / 10-1,9 =0,010.
En déduire l'espèce qui prédomine dans la solution de détartrant.
[A-aq]éq = 0,01[AHaq]éq ; [AHaq]éq prédomine en solution.
Titrage de l'acide lactique dans un détartrant.
Sur l'étiquette de la solution commerciale, on trouve les indications
suivantes : " contient de l'acide lactique, 45 % en masse".
On donne la masse molaire de l'acide tartrique M = 90,0 g/mol et la masse volumique du détartrant µ = 1,13 kg / L.
Afin de déterminer la concentration molaire C en acide lactique apporté
dans la solution de détartrant, on réalise un titrage acido-basique. La
solution de détartrant étant trop concentrée, on prépare par dilution
une solution 10 fois moins concentrée. ( On note C0 la concentration de la solution diluée ).
On dispose de lots de verrerie A, B, C, D suivants :
lot A
|
lot B
|
lot C
|
lot D
|
Pipette jaugée de 5,0 mL
Becher de 50 mL
Eprouvette de 50 mL
|
Pipette jaugée de 10,0 mL
Fiole jaugée de 1,000 L |
Pipette jaugée de 10,0 mL
Fiole jaugée de 100,0 mL |
Eprouvette graduée de 10 mL
Fiole jaugée de 100,0 mL
|
Choisir le lot de verrerie permettant de réaliser la dilution le plus précisément. Justifier l'élimination des trois autres lots.
On choisit le lot C.
Becher et éprouvette ne sont pas suffisamment précis. ( lots A et D éliminés ).
Le facteur de dilution étant égal à 10, le volume de la fiole jaugée
doit être 10 fois plus grand que le volume de la pipette jaugée. ( lot
B éliminé ).
On réalise le titrage pH-métrique d'un volume VA = 5,0 mL de solution diluée par une solution aqueuse d'hydroxyde de sodium ( Na+aq + HO-aq ) de concentration molaire en soluté CB =0,20 mol/L.
Ecrire l'équation de la réaction support du titrage. ( on note AH l'acide lactique ).
AHaq +HO-aq = A-aq +H2O(l).
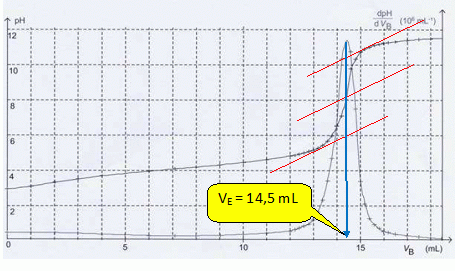
Déterminer graphiquement le volume VE de soution d'hydroxyde de sodium versé à l'équivalence.
On utilise la méthode des tangentes ; on peut remarquer que la courbe dérivée dpH/dVB passe par un maximum à l'équivalence.
En précisant la démarche suivie, calculer C0 et en déduire C.
A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques.
VAC0 = VECB ; C0 = VECB / VA = 14,5 *0,20 / 5,0 =0,58 mol/L.
C = 10 C0 = 5,8 mol/L.
Calculer la masse d'acide tartrique présent dans 1 L de détartrant.
m = C M = 0,58 *90,0 = 522 ~5,2 102 g.
Montrer que le pourcentage massique d'acide lactique présent dans le détartrant est cohérent avec l'indication de l'étiquette.
1 L de détartrant a une masse égale à 1,13 kg = 1130 g.
% massique d'acide lactique : 522 *100 /1130 = 46,2 % ~46 %.
Ecart relatif : ( 46,2-45) / 45 *100 =2,7 %.
|
|
Action du détartrant sur le tartre
On
cherche à déterminer le temps nécessaire à un détartrage efficace, en
étudiant la cinétique d'une transformation réalisée au laboratoire. Le
tartre est essentiellement constitué d'un dépôt de carbonate de calcium
CaCO3.
Lors du détartrage, l'acide lactique réagit sur le carbonate de clacium suivant la réaction d'équation :
CaCO3(s) + 2AHaq = CO2(g) + Ca2+aq + 2A-aq + H2O(l).
Dans un ballon on verse un volume V' = 10,0 mL de la solution diluée de
détartrant précédemment dosée. On introduit rapidement une masse m =
0,20 g de carbonate de calcium. On ferme hermétiquement le ballon avec
un bouchon muni d'un tube à dégagement relié à un capteur de pression.
Ce capteur mesure la surpression due au dégagement de dioxyde de
carbone à la température constante T = 298 K. Cette surpression est
équivalente à la pression du dioxyde de carbone seul dans le ballon. Le
tableau suivant donne quelques valeurs de la pression du dioxyde de
carbone au cours du temps.
t (s)
|
0
|
20
|
40
|
60
|
80
|
100
|
150
|
330
|
600
|
p(CO2) ( hPa)
|
0
|
95
|
121
|
134
|
142
|
146
|
150
|
155
|
155
|
A chaque instant l'avancement x de la réaction est égal à la quantité de matière n(CO2) de dioxyde de carbone formé. Un logiciel permet de calculer ses valeurs.
On donne R = 8,314 J mol-1 K-1 ; volume de dioxyde de carbone à l'état final Vg =310 mL. On suppose que le dioxyde de carbone se comporte comme un gaz parfait.
Donner l'expression de l'avancement x en fonction de la pression du dioxyde de carbone et du volume Vg.
Loi des gaz parfaits : p(CO2)Vg = x RT ;
x = p(CO2)Vg /(RT) = p(CO2)Vg /(8,314*298) = 4,036 10-4 p(CO2)Vg.
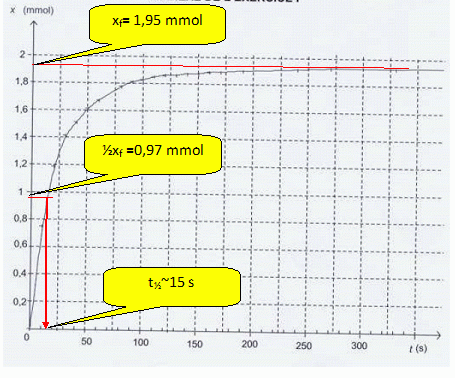
Calculer la valeur de l'avancement à l'état final.
Vg =310 mL = 310 10-6 m3 ; p(CO2) = 155 hPa = 155 102 Pa.
xf = 4,036 10-4 *155 102 * 310 10-6= 1,94 10-3 mol.
On donne la courbe représentant l'évolution de l'avancement au cours du temps.
Vérifier que cette valeur est en accord avec la courbe ci-dessous. Déterminer le temps de demi-réaction.
|
Comment évolue la vitesse de la réaction au cours du temps ? Justifier.
v = 1/V' dx/dt avec V' volume de la solution.
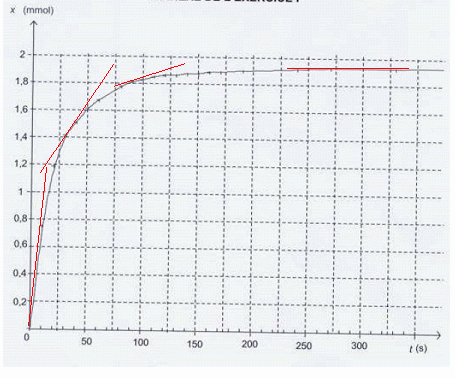
[dx/dt]t est le coefficient directeur de la tangente à la
courbe x=f(t) à la date t. Les tangentes sont de moins en moins
inclinées sur l'horizontale au cours du temps : [dx/dt]t diminue donc.
Or la vitesse est proportionnelle à [dx/dt]t tandis que V' est constant : la vitesse diminue donc au cours du temps.
Lors d'u détartrage d'une cafetière, le mode d'emploi proposé conduit à
utiliser une solution un peu plus concentrée en acide lactique et à
chauffer la solution.
Quelle est en effet la conséquence sur la durée du détartrage ?
Concentration des réactifs et température sont des facteurs cinétiques : la vitesse de la réaction va croître.
|
 Ka ( acide lactique / ion lactate) = 1,3 10-4 à 25°C.
Ka ( acide lactique / ion lactate) = 1,3 10-4 à 25°C.


