|
En
mars 1800, le physicien italien Volta inventa la pile. Elle était
composée d'un empilement de petits disques de cuivre et de zinc
alternés. Chaque disque était séparé l'un de l'autre par un bout de
carton imbibé de saumure,
eau salée de formule ( Na+aq +Cl-aq ). Mais la
pile de Volta fut rapidement abandonnée car la tension à ses bornes
chutait trop rapidement. On fabriqua ensuite la pile à deux liquides
séparés : la pile Daniell,
qui fut longtemps utilisée par ceux qui recherchaient une source durable d'énergie.
Les piles sont devenues des éléments omniprésents de notre vie
quotidienne et l'objet d'un marché mondial considérable. La mise au
point de nouvelles technologes et l'amélioration de leurs performances
ont donc été nécessaires. Par exemple la pile argent-zinc a permis de
remplacer des technolgies dépassées ou interdites pour leurs dangers
pour l'environnement ( piles au mercure ). Elle est utilisée dans
l'horlogerie notamment. Pour la fabriquer il est nécessaire de
fabriquer du zinc de façon industrielle par électrolyse.
La pile de Volta.
Volta utilisait l'eau salée plutôt que l'eau pure pour imbiber le carton entre chaque disque.
Quelle propriété de l'eau salée faisait-il intervenir ?
L'eau salée est un électrolyte : c'est un bien meilleur conducteur électrique que l'eau "pure".
Quelle est la nature des porteurs de charges qui peuvent se déplacer dans le disque de carton imbibé ?
Les ions
Na+aq et Cl-aq peuvent se déplacer.
L'équation de fonctionnement de cette pile s'écrit :
Zn(s) + 2H2O(l) = Zn2+aq + H2(g) +2HO-aq.
L'une des deux demi-équations est : Zn(s) = Zn2+aq +2e-.
Trouver l'autre demi-équation.
2H2O(l) +2e- = H2(g) +2HO-aq.
Rappeler la définition d'un réducteur, puis indiquer quel est le réducteur dans cette pile.
Le zinc est le réducteur : il s'oxyde en ion Zn2+aq et libère deux électrons.
|
On peut représenter le fonctionnement d'un élément de cette pile débitant dans un conducteur ohmique, de résistance R.
Compléter le schéma en indiquant le sens de déplacement des électrons , la borne positive et la borne négative.
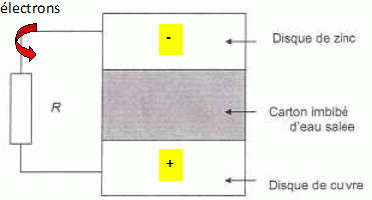
|
Quel
appareil pourrait-on brancher dans le montage pour mesurer l'intensité
du courant dans le conducteur ohmique ? Comment le brancherait-on ?
Un ampèremètre monté en série avec le conducteur ohmique mesure l'intensité du courant.
Production du zinc.
Le zinc peut être préparé par électrolyse d'une solution aqueuse de sulfate de zinc ( Zn2+aq +SO42-aq ) acidifiée par l'acide sulfurique ( 2H+aq + SO42-aq).
On observe un dégagement de dioxygène sur l'anode et un dépôt de zinc
sur la cathode. Les électrodes utilisées sont inertes et l'ion sulfate
ne participe pas aux réactions électrochimiques.
On donne : couples oxydant / réducteur : Zn2+aq / Zn(s) ; H+aq / H2(g) ; O2(g) / H2O(l).
NA = 6,0 1023 mol-1 ; 1 F = 9,65 104 C mol-1 ; e = 1,6 10-19 C ; M(Zn) = 65,4 g/mol.
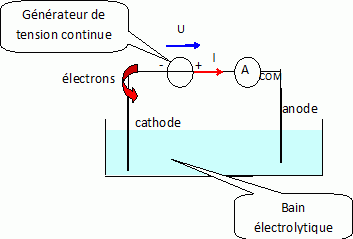
Faire le schéma de l'électrolyse d'une solution de sulfate de zinc qui pourrait être réalisée au laboratoire.
Préciser
la nature et le sens du déplacement des porteurs de charges dans le
circuit électrique à l'extérieur de l'électrolyseur ainsi que la
polarité du générateur.
Indiquer les formules chimiques de toutes les espèces présentes à l'état initial dans la solution.
Eau H2O ; Zn2+aq ; SO42-aq ; H+aq ; HO-aq très minoritaire.
Ecrire
les demi-équations des réactions susceptibles de se produire aux
électrodes compte tenu des observations et sachant que l'eau subit une
oxydation à l'anode.
Réduction à la cathode : Zn2+aq +2e- = Zn(s).
Oxydation de l'eau à l'anode : H2O(l) = ½O2(g) + 2H+aq + 2e-.
Ecrire l'équation de la réaction de cette électrolyse.
Zn2+aq +H2O(l) = Zn(s) + ½O2(g) + 2H+aq.
S'agit-il d'une transformation spontanée ou forcée ? Justifier.
L'électrolyse
nécessite un apport d'énergie sous forme électrique de la part du
générateur ( ce dernier impose le sens d'évolution de la réaction
chimique ) : il s'agit d'une transformation forcée.
Dans l'industrie, l'intensité du courant est I = 4,3 104 A et la tension maintenue entre les électrodes U =3,5 V.
Calculer la quantité d'électricité Q qui traverse l'électrolyseur en 24 heures.
Q = I Dt = 4,3 104 *24*3600 =3,7152 109 ~3,7 109 C.
Montrer que la quantité d'électrons qui circulent pendant cette même durée est ne- =3,9 104 mol.
ne- =Q / F = 3,7152 109 / 96500 =3,85 104 ~3,9 104 mol.
|
|
Calculer alors n(Zn), la quantité de zinc formé, puis m(Zn) la masse de zinc produit en 24 heures.
Le zinc étant bivalent : n(Zn) = ½ ne- =0,5*3,85 104 ~1,9 104 mol.
m(Zn) = n(Zn) * M(Zn) = 1,925 104 *65,4 =1,26 106 g = 1,3 tonnes.
Vérifier que la concentration en ion zinc dans la solution au bout de 24 heures est [Zn2+]fin = 6,1 mol/L. Elle était de 10 mol/L initialement, pour un volume V = 5,0 m3 de solution dans la cuve.
n(Zn2+) début = [Zn2+]début V = 10 * 5,0 103 =5,0 104 mol.
n(Zn2+) disparu =1,925 104 mol.
n(Zn2+) fin =n(Zn2+) début -n(Zn2+) disparu =(5,0-1,925) 104 =3,075 104 mol.
[Zn2+]fin = n(Zn2+) fin / V = 3,075 104 /5000 =6,15 ~6,2 mol/L.
|
|

