|
Indice d'acide, indice d'iode d'une huile d'olive, hydrodynamique : BTS QIABI 2011. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||
| .
. |
||||||||||||
|
||||||||||||
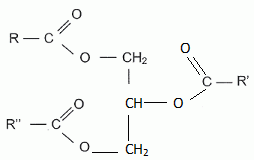 Le glycérol est le propan-1, 2, 3-triol. Donner la formule semi-développée du glycérol. HO-CH2-CHOH-CH2OH. Donner la formule générale d'un ester. Les groupes alkyles seront notés R1 et R2. R1-COO-R2. Justifier le terme triester du glycérol. Un triglycéride possède trois fonctions ester. Un triglycéride est obtenu à partir d'un trialcool, le glycérol.
L'équation de la réaction de dosage s'écrit donc : R-COOH aq + HO-aq = RCOO-aq + H2O(l). Rappeler l'expression de la constante d'acidité Ka d'un couple acide base noté RCOOH / RCOO-. Ka = [RCOO-][H3O+] / [RCOOH]. On donne à 25°C pKa(RCOOH/ RCOO-) = 5. Exprimer puis calculer la constante d'équilibre K de la réaction de dosage. K = [RCOO-aq] / ([R-COOH aq][HO-aq]) = Ka / ([H3O+][HO-aq]) = Ka /Ke = 10-5 / 10-14 = 109. Cette réaction peut-elle servir de support à un dosage ? K est grande, la réaction est donc totale. Les réactions acide base étant de plus rapides, cette réaction peut servir de support à un dosage. A l'équivalence du dosage, quelle espèce majoritaire est présente ? Que peut-on en déduire concernant le pH ? Les ions potassium sont "spectateurs". RCOO-aq est majoritaire, c'est une base qui réagit patiellement avec l'eau : le pH de la solution sera donc supérieur à 7. Parmi les indicateurs colorés suivants, lequel est le plus approprié ? Justifier.
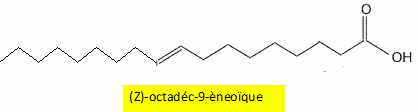
La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent, donc le rouge de crésol est le plus approprié. La quantité de matière d'ion hydroxyde versée à l'équivalence est égale à la quantité de matière d'acides gras libres et vaut n = 1,74 mmol. En déduire l'indice d'acide de l'huile d'olive vierge utilisée. Sa valeur est-elle conforme aux normes ? Masse volumique de l'huile d'olive : r =0,91 g/mL. Masse d'acide oléïque : m = n M = 1,74 10-3 * 282 =0,49068 g dans V = 20,0 mL d'huile. Masse du volume V d'huile : V r = 20 *0,91 = 18,2 g. L'indice d'acide est le pourcentage en masse d'acides libres dans une huile. 0,49068 / 18,2 = 0,027 ( 2,7 %), valeur inférieure à la limite de 3,3 % : l'huile est donc conforme.
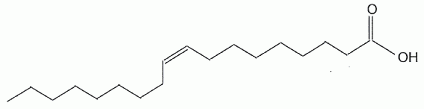
Indice d'iode d'une huile d'olive. Pour déterminer l'indice d'iode d'une huile, une masse m =0,20 g d'huile est mélangée, dans un solvant approprié, à 20 mL d'un réactif W contenant du diiode I2. En notant R-CH=CHR' une molécule insaturée présente dans l'huile, l'équation chimique de la réaction chimique ayant lieu s'écrit : R-CH=CH-R' +I2 = R-CHI-CHIR'. Donner en justifiant la nature de cette réaction. Addition du diiode ( ajout d' atomes sur une molécule insaturée ) sur une liaison double carbone carbone, site riche en électrons ( donc nucléophile) : addition électrophile. Après avoir laissé reposer le mélange 40 minutes à l'obscurité en remuant de temps en temps, le diiode restant est extrait de la phase organique et dosé par une solution aqueuse de thiosulfate de sodium ( 2Na+aq + S2O32-aq ) de concentration Cthio = 0,10 mol/L en ion thiosulfate. Le volume équivalent obtenu est VE = 8,1 mL. La concentration en diiode du réactif W n'étant pas connue, un témoin est réalisé, dans les mêmes conditions, mais sans introduire d'huile. Le dosage du diiode introduit dans le témoin donne un volume équivalent VT =21,8 mL. Etablir en passant par les demi-équations électroniques, l'équation chimique de la réaction de dosage du diiode. Demi-équations électroniques correspondant aux deux couples mis en jeu : Lors du dosage S2O32- est oxydé ; I2 est réduit. 2S2O32- =S4O62- + 2e- (1) oxydation du réducteur le plus fort. I2 +2e- = 2I- (2) réduction de l'oxydant le plus fort En ajoutant (1) et (2) on écrit l'équation du dosage : I2 + 2S2O32-= 2I- + S4O62- . Donner la relation existant entre : - la quantité de matière nr de diiode ayant réagi avec les molécules insaturées de l'huile. nr =nt -nd =½Cthio (VT-VE). - la quantité de matière nd de diiode dosé par le mélange ayant contenu l'huile. nd =½nE thio = ½Cthio VE. - la quantité de matière ni de diiode introduite. nt =½nT thio = ½Cthio VT. En déduire la masse m de diiode ayant réagi. M(I) = 126,9 g/mol. m = nr M(I2) =½Cthio (VT-VE)M(I2) =0,5 *0,10 ( 21,8 -8,1) 10-3 *2*126,9 =0,17385 ~0,17 g. l'indice diode est la masse de diiode ( exprimée en gramme) capable de se fixer sur les insaturations présentes dans 100 g d'huile. Déterminer l'indice diode de l'huile d'olive. 0,17385 g de diiode réagit avec 0,20 g d'huile d'olive ; 0,17385 *100/0,20 =86,92 ~87 g de diiode réagit avec 0,20 g d'huile d'olive.
|
||||||||||||
|
|