|
Extraction
et synthèse du camphre :
concours
Capes 2011 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||||||
| .
. |
|||||||||||||||
|
|||||||||||||||
|
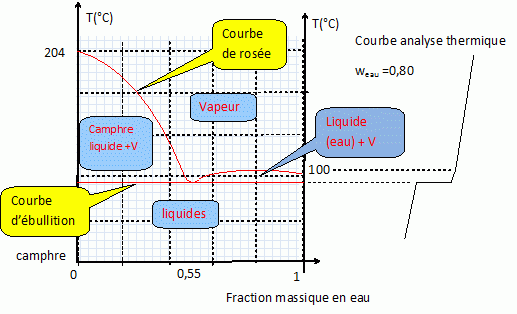
L'arbre de camphre pousse principalement en Chine et au Japon. Depuis plusieurs années, le (+) camphre est extrait de différentes façons selon la région du monde. Il va s'agir ici détudier l'une des techniques : l'entraînement à la vapeur. Le camphre est peu soluble dans l'eau, il forme avec l'eau, un hétéroazéotrope de composition massique en eau weau = 0,55. On obtient par cette méthode un camphre de pureté assez faible. Il s'agit ensuite de le purifier par sublimation. Généralités. Quel est le nom du premier appareil utilisé aux environs du IXè siècle lors de l'extraction des huiles essentielles ? L'alambic fut décrit par les perse au IXè siècle. Lors d'extraction de molécules organiques, on peut réaliser une décoction et une infusion. Définir ces deux termes. Une décoction : plonger la plante dans de l'eau froide, faire bouillir quelques minutes puis filtrer. Une infusion : verser l'eau bouillante sur la plante, couvrir et laisser infuser quelques minutes, filtrer éventuellement. Représenter un schéma annoté d'un montage d'hydrodistillation.  1 - ballon à fond rond ; 2 - chauffe - ballon ; 3- thermomètre ; 4 - réfrigérant à eau ; 5- erlenmeyer.
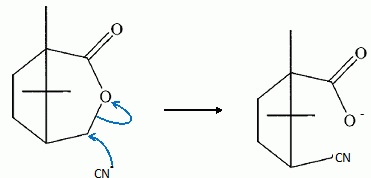
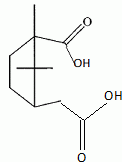
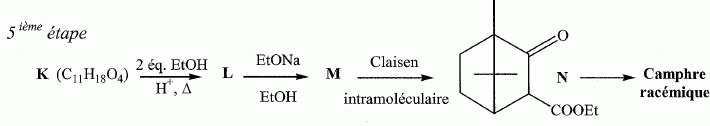
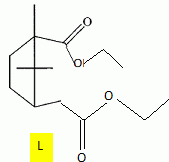
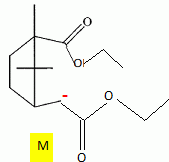
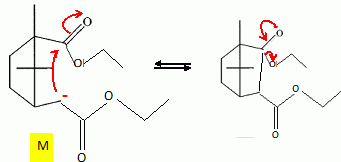
Etude du diagramme binaire eau-camphre. L'eau s'épuise rapidement, sa température d'ébullition étant inférieure à celle du camphre. Purification du camphre extrait par sublmimation. 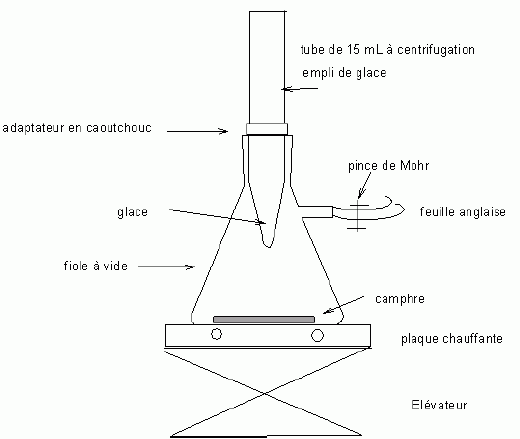 Expliquer succinctement son principe de fonctionnement. En chauffant modérément sous vide, à une pression inférieure à celle du point triple, le camphre solide se volatilise ; les vapeurs se condensent en un composé purifié sur le "doigt" de glace froid. Définir la sublimation. La sublimation représente le pasage direct d'un solide à l'état gazeux, sans passer par l'état liquide. La sublimation nécessite de fournir de l'énergie au solide : c'est une transition de phase endothermique. Synthèse organique du camphre racémique. Le camphre possède plusieurs stéréoisomères. L'un d'eux est représenté ci dessous avec sa vue de dessus. Les atomes de carbone asymétriques sont repérés par "*". 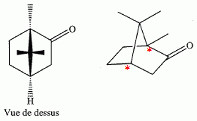 En déduire le nombre théorique de stéroisomères de configuration. Combien en observe t-on réellement du fait du pont ? Justifier. Avec deux atomes de carbone asymétriques on peut s'attendre à 22 = 4 stéréoisomères. La présence du pont conduit à une structure rigide : on observera seulement deux énantiomères. 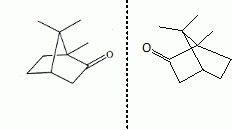 L'une des nombreuses synthèses du camphre racémique est décrite ci-dessous : 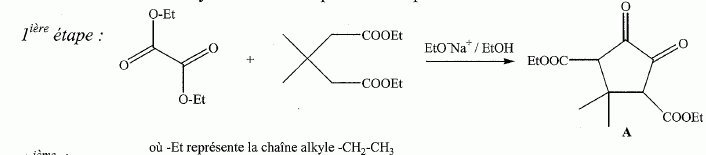 Justifier le caractère acide des protons en a du groupe ester. Lors du départ de ce proton, la charge négative résultante sur l'atome de carbone est stabilisée, répartie sur un plus grand nombre d'atomes. Plus la base est stable, plus le proton est acide. 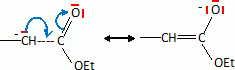 Quel est le rôle de l'ion éthanolate EtO- , de l'éthanol ? C'est une base forte capable d'arracher un proton situé en a du groupe ester. L'éthanol joue le rôle de solvant polaire protique. En présence de sodium, il génère la base EtO-.
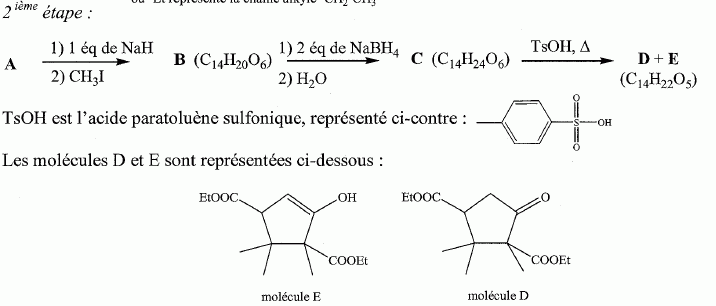 L'ion hydrure est une base forte. Donner la formule topologique de B et C après avoir préciser la nature de la réaction subie par l'iodure de méthyle. L'iodure de méthyle conduit au carbocation CH3+.
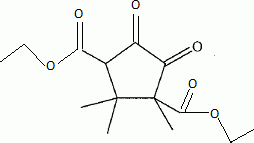
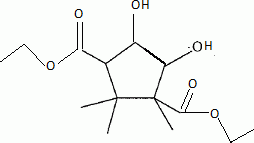
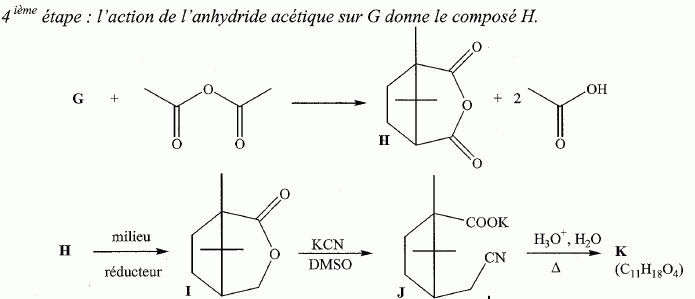
Quel est le rôle de NaBH4 ? C'est un réducteur doux, il réduit les fonctions cétone en alcool, sans réduire les fonctions ester.( contrairement à LiAlH4 ). L'acide paratoluène sulfonique est un donneur de protons. Justifier le caractère particulièrement acide de cette substance comparé à celui de l'éthanol. L'anion résultant du départ du proton est stabilisée par résonance avec le cycle benzénique. Dans le cas de l'éthanol, la charge de l'anion reste sur le seul atome d'oxygène. Plus la charge de l'anion est délocalisée sur un plus grand nombre d'atomes, plus la base est stable et plus l'acide est fort. Justifier les données suivantes des spectres IR de D et E. La molécule E possède un pic large vers 3200 cm-1; ce pic disparaît pour la molécule D au profit d'un pic fin et intense vers 1700 cm-1. E possède un groupe OH " enol " associé par liaisons hydrogène intermoléculaires. D possède une fonction cétone. Proposer un mécanisme justifiant la formation de D. 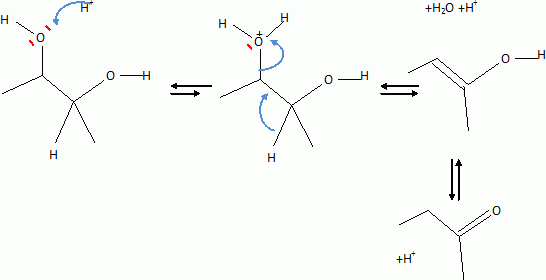 Quel est le nom de l'équilibre existant entre D et E ? Tautomérie céto-énolique. Etude de l'étape 3. 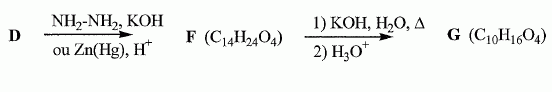 Donner les formules topologiques de F et G. Réduction de la fonction cétone: ( Clemensen Zn /Hg en milieu acide ou Wolff-Kishner NH2-NH2 + KOH ), puis hydrolyse basique ( saponification ) des groupes esters, suivie d'un retour en milieu acide. 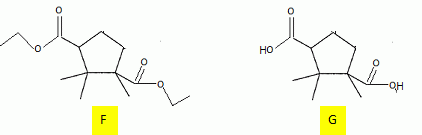
|
|||||||||||||||
| |
|||||||||||||||
|
|