|
Concours ESSA Lyon 2010 : le paracétamol. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
Le paracétamol ou N-(4-hydroxyphényl)éthanamide est le principe actif d’une famille de médicaments antipyrétiques (traitement de la fièvre) et analgésiques (traitement de la douleur). On donne la formule du paracétamol. 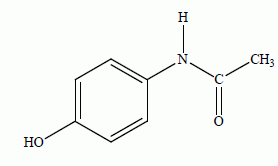 Masse molaire moléculaire du paracétamol M= 150 g.mol-1. Etude de la synthèse du paracétamol :
Donner l’expression du quotient de réaction dans l’état initial, Qr,i. Répondre à ce questionnaire à choix multiple (de 0 à 5 réponses justes possibles). Ne pas justifier. 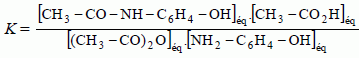 Vrai. Vrai.b) La valeur de K diminue si on augmente les concentrations des réactifs dans l’état initial. Faux. K ne dépend que de la température. c) La valeur de K est indépendante de la température T. Faux. d) Si Qr,i < K, le système évolue spontanément dans le sens inverse de l’équation de réaction. Faux. e) Si Qr,i < K, la quantité de paracétamol augmente entre l’état initial et l’état d’équilibre. Vrai. Le système évolue spontanément dans le sens direct. Etude des propriétés acido-basiques du paracétamol : Cette partie a pour but d’étudier les propriétés acido-basiques du paracétamol, noté AH, en solution aqueuse. Sa base conjuguée, dont la formule semi-développée est précisée ci-dessous, sera notée A-. 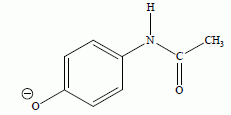 La réaction entre le paracétamol AH et l'eau modélise la transformation étudiée. On dissout un comprimé effervescent de Doliprane 500 dans un verre d’eau de volume V = 10 cL d’eau. La masse correspondante de paracétamol dissoute est m = 500 mg. On note S la solution ainsi préparée. À 25 °C, la mesure du pH de la solution S à l'équilibre donne 5,5. Déterminer, à l'équilibre, la concentration [H3O+]éq en ions oxonium dans la solution S. [H3O+]éq = 10-pH = 10-5,5 = 3,2.10-6 mol/L. Le paracétamol AH réagit avec l'eau. Écrire l'équation de la réaction modélisant cette réaction. AH aq + H2O(l) =H3O+aq +A-aq. Déterminer l'avancement xmax de la réaction. L'eau est en large excès, le paracétamol est en défaut. xmax = quantité de matière de paracétamol = m / M = 0,500 / 150 = 3,33 10-3 mol. Déterminer l'avancement final xf de la réaction. L'avancement final est égal à la quantité de matière d'ion oxonium H3O+. xf = [H3O+]éq V = 3,2.10-6 *0,10 =3,2.10-7 mol. En déduire les concentrations [A-]éq et [AH]éq à l'équilibre. La solution est électriquement neutre ( HO- négligeable à pH = 5,5 ). [H3O+]éq = [A-]éq =3,2.10-6 mol/L. Conservation de A : [AH]éq + [A-]éq = xmax /V =3,33 10-3 /0,10 =3,33 10-2 mol/L. [AH]éq =3,33 10-2 -3,2.10-6 ~3,33 10-2 mol/L. Calculer l'ordre de grandeur du taux d'avancement fïnal t. t =xf / xmax = 3,2.10-7/ 3,33 10-3 ~1 10-4. Le taux d'avancement finale est très inférieur à 1 : la réacrion de AH avec l'eau est très limitée.
Etablir l'expression du pKa du couple AH/A- en fonction du pH et calculer sa valeur. Ka = [H3O+]éq [A-]éq / [AH]éq = [H3O+]2éq / [AH]éq ~ [H3O+]2éq /c. log Ka =2 log[H3O+]éq -log c ; pKa = 2pH+log c = 2*5,5 +log 3,33 10-2 =11-1,5 = 9,5. Le pH de l'estomac humain varie entre 1,5 (pendant la nuit) et 5 (en début de digestion). Pour chacune de ces deux valeurs du pH, quelle est l’espèce, AH ou A-, qui prédomine dans l’estomac après la prise d’un comprimé de 500 mg ? Justifier. pH=5,5 ; pKa = 9,5 : à pH très inférieur à pKa, la forme acide AH du couple acide / base prédomine. Etude des propriétés redox d'un précurseur du paracétamol. Une méthode pour doser le paracétamol consiste en une hydrolyse du paracétamol, suivie d’un dosage d’oxydoréduction du produit de l’hydrolyse, le para-aminophénol, par les ions Ce4+. Lors de la réaction, celui-ci est susceptible d’être oxydé en para-benzoquinone C6H4O2 en présence d’ions Ce4+. Sachant que l’oxydation du para-aminophénol NH2-C6H4-OH en para-benzoquinone C6H4O2 produit également des ions ammonium NH4+, donner la demi-équation d’oxydation correspondante. NH2-C6H4-OH +H2O= C6H4O2 + NH4++ 2e- +H+. Donner la demi-équation de réduction des ions Ce4+ en ions Ce3+. Ce4+ +e- = Ce3+. En déduire l’équation-bilan de la réaction entre les ions Ce4+ et le para-aminophénol. NH2-C6H4-OH +H2O= C6H4O2 + NH4++ 2e- +H+. 2Ce4+ +2e- = 2Ce3+. Puis ajouter et simplifier : NH2-C6H4-OH +H2O+ 2Ce4+= C6H4O2 + NH4++ 2Ce3+ +H+.
|
|||||||
| |
|||||||
|
|