Lorsqu’on trempe une
lame métallique de zinc dans une solution de dibrome, une réaction
chimique intervient entre le métal et le dihalogène, qui produit des
ions bromure et des ions zinc II.
La constante d’équilibre de cette réaction vaut : K = 5. 1061.
Ecrire
l’équation-bilan de cette réaction.
Oxydation du zinc : Zn(s) = Zn2+aq + 2e-.
Réduction du dibrome : Br2 aq +2e- = 2Br-aq.
Bilan : Zn(s) + Br2 aq = Zn2+aq +2Br-aq.
On
dissout m=22,6 g de bromure de zinc (ZnBr2) dans V=500 mL
d’eau pure.
Calculer
les concentrations des ions Zn2+ et Br- en
solution. On donne M(Zn) = 65,4 g/mol ; M(Br) =79,9 g/mol
M(ZnBr2) = 65,4 + 2*79,9 =225,2 g/mol.
n(ZnBr2) = m / M(ZnBr2)
=22,6 /225,2 =0,10036 mol.
[Zn2+aq] = n / V = 0,10036/0,500 =0,2007 ~0,201 mol/L.
La solution est électriquement neutre : [Br-aq] =2[Zn2+aq]
=2*0,2007 =0,401 mol/L.
|
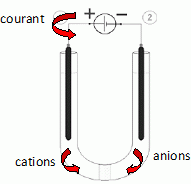
On verse 100 mL de la solution dans un tube en U, muni
en son milieu d’une paroi poreuse perméable aux ions.
Deux électrodes de graphite disposées à chaque branche du tube sont
reliées par un générateur de f.e.m. E= 2,5 V, selon le schéma
ci-dessous.
L’intensité peut être mesurée à l’aide d’un ampèremètre intégré au
générateur (non représenté sur la figure).
|
Indiquer sur le
schéma le sens du courant (si courant il y a) dans les différentes
parties du montage :
• conducteur métallique (entre le générateur et les électrodes),
• solution aqueuse.
Au bout de quelques minutes, la solution dans la branche (1) prend une
teinte brunâtre.
Préciser
les équations des réactions électrochimiques qui interviennent à chaque
électrode.
Préciser
la nature (en fonction de leur rôle électrochimique) des électrodes.
(1) oxydation des ions bromures à l"anode positive : 2Br-aq
= Br2 aq +2e-.
(2) réduction des ions zinc(II) à la cathode négative : Zn2+aq
+ 2e- = Zn(s).
Donner le
bilan de l’électrolyse et préciser la constante d’équilibre K′.
Bilan
: Zn2+aq +2Br-aq = Zn(s) + Br2 aq.
K' = [Br2 aq] / ([Zn2+aq][Br-aq]2)
=1/K = 1 / 5. 1061=2 10-62.
Au bout
d’une heure d’électrolyse, on débranche le générateur. La pesée de
l’électrode de la branche (2) montre qu’elle a gagné : Δm = mfinale
(électrode (2)) - minitiale (électrode (2)) = 122 mg.
Calculer
les quantités des produits de l’électrolyse au bout d’une heure.
(2) : 122 mg de zinc se dépose sur l'électrode.
Quantité de matière correspondante : n(Zn) = Δm / M(Zn) =0,122 / 65,4
=1,865 10-3 mol.
Zn2+aq +2Br-aq = Zn(s) + Br2 aq.
n(Br2 aq) = n(Zn) = 1,865 10-3 mol.
Masse de dibrome formé : n(Br2 aq) M(Br2) =1,865
10-3 *2*79,9 = 0,298 g.
Quelle a été
l’intensité moyenne du courant pendant l’heure qu’a duré l’électrolyse
?
Quantité de matière d'électrons : n(e-) = 2 n(Zn) = 2*1,865
10-3 = 3,73 10-3 mol.
Quantité d'électricité correspondante : Q = n(e-) F = 3,73 10-3*96500
=360 C
Intensité moyenne : I = Q / t = 360 / 3600 = 0,100
A.
|
|
Après une heure d’électrolyse, on remplace le générateur par un
résistor de résistance R.
Cocher
les cases sur le document réponse se rapportant au système dans cette
nouvelle situation.
Electrode (1) = pole +. Vrai.
Zn(s) + Br2
aq = Zn2+aq
+2Br-aq ; K = 5 1061
; la réaction est totale dans le sens direct.
Le dispositif fonctionne
comme une pile : réduction du dibrome en (1), cathode positive.
Electrode (1) = anode. Faux.
L'électrode (1) est le siège d'une réduction. Vrai.
Le système est à l'équilibre. Faux.
Le système évolue dans le
sens direct tant que le quotient de réaction est inférieur à la
constante d'équilibre K.
Le résistor est traversé par un courant allant de (2) vers (1). Faux.
(1) est la borne positive
de la pile.
Le courant qui circule est alternatif. Faux.
Une pile délivre un
courant continu.
[Br-aq] augmente globalement au cours du temps. Vrai.
réduction du dibrome en
(1) en ion bromure.
[Zn2+aq] augmente globalement au cours du
temps. Vrai.
Oxydation du zinc à
l'anode négative (2) en ion Zn2+aq.
Au bout de plusieurs dizaines de minutes, l’intensité finit par
s’annuler.
Déterminer
alors les concentrations des ions en solution.
La pile ne fonctionne plus lorsque le quotient de réaction final est
égal à la constante d'équilibre K ou lorsque l'un au moins des réactifs
a disparu.
Le dibrome formé lors de l'électrolyse est
entierement consommé lors du fonctionnement de la pile.
[Br-aq]fin = 0,401 mol/L.
Le zinc formé lors de l'électrolyse est entierement consommé lors du
fonctionnement de la pile.
[Zn2+aq]fin ~0,200 mol/L.
|
|
