|
Réaction de fusion ; projet ITER : concours technicien météo 2010. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||
| .
. |
|||||||
|
|||||||
|
L'objectif du projet ITER est de démontrer la possibilité scientifique et technologique de la production d'énergie par la fusion des atomes. La fusion contrôlée représente un défi scientifique et technologique majeur qui pourrait répondre au problème crutial de disposer, à plus ou moins long terme, de nouvelles ressources énergétiques. A côté de l'énergie de fission, l'énergie de fusion représente l'espoir d'avoir une source d'énergie propre et abondante au cours du XXIeè siècle. A l'heure où la raréfaction des énergies fossiles est prévue d'ici 50 ans, il est d'une importance vitale d'explorer le potentiel de toutes les autres sources d'énergie. Etude de la réaction de fusion. Le concept solaire de production d'énergie est basé sur une réaction dont la probabilité de se réaliser est extrêmement faible sur note planète. Mais l'idée reste bonne ! Il suffit de remplacer l'hydrogène par des noyaux qui ont un maximum de chance de fusionner sur terre, en l'occurence, ceux de deutérium et de tritium, deux isotopes de l'hydrogène [...] en les chauffant à des températures très élevées, de l'ordre de 100 millions de degrés. C'est donc sur cette réaction que se concentrent les recherches concernant la fusion controlée. 31H + 21H --> 42He +10n. On donne : On donne m(31H) = 3,01550 u ; m(21H) =2,01355 u ; m(42He) = 4,00150 u ; m(10n) = 1,00866 u. 1 u = 1,66054 10-27 kg ; 1 MeV = 1,602 10-13 J ; c = 2,998 108 m /s ; NA = 6,023 1023 mol-1. Calculer la variation de masse au cours de la réaction de fusion. Donner sa valeur en kg et commenter son signe. Dm = m(10n) +m(42He) -m(21H) -m(31H) Dm =4,00150 + 1,00866-3,01550-2,01355 = -1,889 10-2 u. 1,889 10-2 * 1,66054 10-27 = -3,13676 10-29 kg. La masse est une forme de l'énergie ; le signe négatif traduit le fait que la fusion libère de l'énergie dans le milieu extérieur.
Vérifier que le nombre N de noyaux présents dans 1,0 g de noyaux de deutérium est 3,0 1023 noyaux.
Quelques précisions sur le tritium. Le tritium est radioactif ß-; sa demi-vie vaut t1/2 = 12,3 ans. Ecrire l'équation de la désintégration du noyau de tritium 31H en rappelant les lois utilisées. 31H = AZX + 0-1e Conservation de la charge : 1=Z-1 ; Z=2. ( élément hélium ) Conservation du nombre de nucléons : 3 = A 31H = 32He + 0-1e. On dispose d'un échantillon contenant 1 kg de tritium. Quelle masse de tritium restera dans cet échantillon au bout de 36,9 ans ? 36,9 = 3 fois 12,3 = 3 demi-vies radioactives du tritium. A chaque demi-vie, la masse initiale est divisée par deux. Au bout d'une demi-vie, 12,3 ans, il reste 0,5 kg de tritium. Au bout de deux demi-vies, 24,6 ans, il reste 0,25 kg de tritium. Au bout de trois demi-vies, 36,9 ans, il reste 0,125 kg de tritium.
|
|||||||
| |
|||||||
|
|
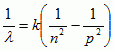 .
.