|
La solution aqueuse de diiode : concours Kiné Nantes 2011. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
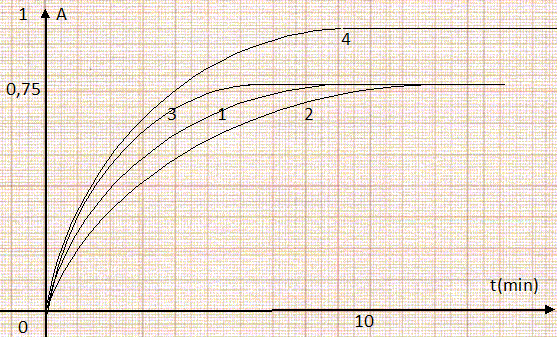
On donne : I2aq / I-aq ; S2O82-aq / SO42-aq. Suivi expérimental temporel de la transformation. Etablir l'équation de la réaction liée à la transformation chimique. Oxydation : 2 I-aq = I2aq + 2e- ; réduction : S2O82-aq + 2e-= 2SO42-aq. Bilan : 2 I-aq + S2O82-aq = I2aq + 2SO42-aq. Un manipulateur désire obtenir l'évolution de l'absorbance du système chimique au cours du temps par une console d'acquisition reliée à un ordinateur. Pour cela il effectue les réglages suivants : il choisi le faisceau du colorimètre sur une radiation lumineuse rouge, effectue le réglage du blanc grâce à une solution de diiode ( c = 4 10-5 mol/L ) puis lance l'acquisition pour une durée totale de 10 minutes dès que les ions iodures entrent en contact avec les ions peroxodisulfate. Justifier les choix de l'opérateur. La solution de diiode présente un maximum d'absorption vers 350 nm. Pour réaliser le zéro " faire le réglage du blanc", on doit se placer à une longueur d'onde pour laquelle le diiode n'absorbe pas. Pour suivre l'évolution de l'absorbance, on se placera à une longueur d'onde de 350 nm, pour laquelle le diiode présent un maximum d'absorption. Quant au choix de la concentration, aux faibles concentrations, absorbance et concentration sont proportionnelles. Influence de quelques facteurs cinétiques. On réalise plusieurs expériences. On obtient les courbes suivantes :
On utilise une solution S1 d'iodure de potassium de concentration c1 = 2,0 10-2 mol/L et une solution S2 de peroxodisulfate de sodium de concentration c2 = 5,0 10-3 mol/L.
Dans l'expérience 5, le volume total de la solution diffère de 4,0 mL, volume total des solutions 1 à 4. Les concentrations des espèces sont donc modifiées, par rapport aux 4 premières expériences.. Expliquer ce différencie les courbes (1, 2, 3 ) de la courbe 4 ? Quelle est la conséquence sur l'état du système chimique de chacune ? L'absorbance atteint la valeur 1 ( courbe 4) et 0,75 pour les courbes 1, 2, 3. Or seul le diiode absorbe à la longueur d'onde choisie ; de plus, absorbance et concentration du diiode sont proportionnelles. L'ion peroxodisulfate est le réactif limitant : expériences 1, 3 et 4, n(S2O82-aq) = 5 10- 6 mol ; n(I2aq) final = 5 10- 6 mol et [I2aq] =5 10- 6 / 4 10-3 =1,25 10-3 mol/L. expérience 2, n(S2O82-aq) = 7,5 10- 6 mol et [I2aq] =7,5 10- 6 / 4 10-3 =1,87 10-3 mol/L. Ajoutns que l'absorbance est proportionnelle à [I2aq] . La transformation chimique est supposée totale et irréversible. Décrire qualitativement l'état initial et l'état final du système chimique de l'expérience 1. Initial : n(S2O82-aq)= 5 10- 6 mol ; n(I-aq) = 2 10- 5 mol. S2O82-aq est en défaut et I-aq est en excès. Final : n(S2O82-aq)= 0 mol ; n(I-aq) = 1,0 10- 5 mol. [I2aq] fin =5 10- 6 / 4 10-3 =1,25 10-3 mol/L. Identifier les expériences correspondant aux courbes 1, 2, 3, 4 en justifiant clairement. Expérience 1 : T = 25°C ; n(S2O82-aq)= 5 10- 6 mol ; n(I-aq) = 2 10- 5 mol. Expérience 3 : T = 25°C ; n(S2O82-aq)= 5 10- 6 mol ; n(I-aq) = 4 10- 5 mol. La concentration et la température sont des facteurs cinétiques , donc l'expérience 3 correspond à la courbe 3. Expérience 4 : température inférieure 10°C; n(S2O82-aq)= 5 10- 6 mol ; n(I-aq) = 2 10- 5 mol. Donc l'expérience 4 correspond à la courbe 2. Par suite l'expérience 1 correspond à la courbe 1.
Evolution du système chimique. Contrôle de qualité.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|