|
Thermodynamique
: l'eau dans tous ses états :
concours ITPE 2010 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||
| .
. |
|||||||
|
|||||||
|
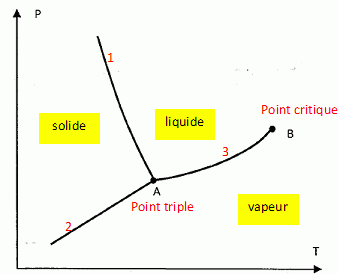
On donne le diagramme (P, T) de l'eau.  Que représente chacune des trois courbes tracées. Préciser la forme stable de l'eau dans les trois zones du plan. Donner les noms des points A et B. 1 : courbe de fusion solidification ; 2 : courbe sublimation condensation ; 3 : courbe vaporisation liquéfaction.
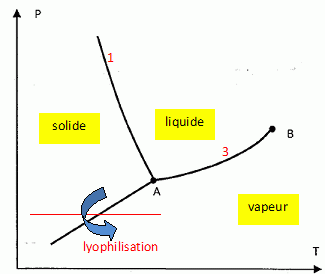
La lyophilisation d'un aliment consiste en la sublimation de l'eau contenue dans l'aliment.
Détermination des grandeurs thermodynamiques de l'eau. Pour déterminer l'enthalpie massique de fusion de la glace, on utilise une méthode calorimétrique. On néglige les transferts thermiques entre le calorimètre et l'extérieur. Un calorimètre contient une masse mF = 100 g d'eau à tF = 18,3°C. On y verse une masse mc=80,0 g d'eau à tc=60,0°C. La température d'équilibre est téq = 35,9°C. En déduire la capacité thermique, notée µ, du calorimètre et de ses accessoires. ceau = 4,18 kJ kg-1 K-1. Energie gagnée par les corps froids, calorimètre et eau froide : Q1 = (µ +mF ceau ) (téq -tF ). Energie cédée par l'eau chaude : Q2 = mc ceau (téq -tc ). Le système est adiabatique : Q1 +Q2 =0. (µ +mF ceau ) (téq -tF ) + mc ceau (téq -tc ) = 0 µ = - mc ceau (téq -tc ) /(téq -tF ) - mF ceau. µ =0,08 *4,18 103 (35,9-60) / (35,9 -18,3)- 0,1 *4,18 103 = 457,9 -418 = 39,9 J K-1. On considère un calorimètre contenant une masse d'eau me =315 g à tF =18,3°C. On y introduit un glaçon de masse mg=42,0 g à tg =-25,5 °C. Il y a fusion totale de la glace et la température d'équilibre est t'éq =5,60 °C. On recommence l'expérience ( même calorimètre, même masse d'eau initiale, même température ), mais on introduit cette fois un glaçon de masse m"g = 35,0 g à la température de 0,00°C. La nouvelle température d'équilibre est t"éq =8,80°C. Déduire de ces expériences, l'enthalpie massique de fusion notée Lf de la glace et la capacité thermique massique cg de la glace. Expérience 1 : Energie cédée par les corps chauds, calorimètre et eau : Q1 = (µ +me ceau ) (t'éq -tF ). Energie gagnée par le corps froid : Q2 = mg [ cg (0 -tg ) + Lf + ceau (t'éq -0 )]. Le système est adiabatique : Q1 +Q2 =0. (µ +me ceau ) (t'éq -tF )+ mg [ cg (0 -tg ) + Lf + ceau (t'éq -0 )]. (39,9 +0,315*4180)(5,60-18,3) + mg [25,5 cg +Lf +4180*5,6]=0 -17228,82 +0,042[25,5 cg +Lf +23408]=0 3,868 105 - 25,5 cg -Lf =0 (1).
|
|||||||
|
|
|||||||
|
|