|
Dosage pour déterminer la durée de fonctionnement d'une pile, bac S Polynésie 2012. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
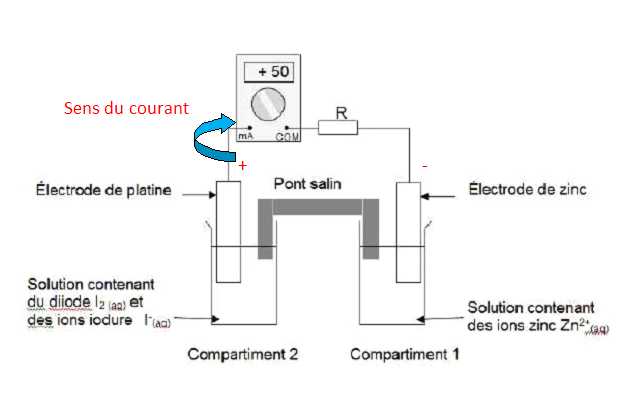
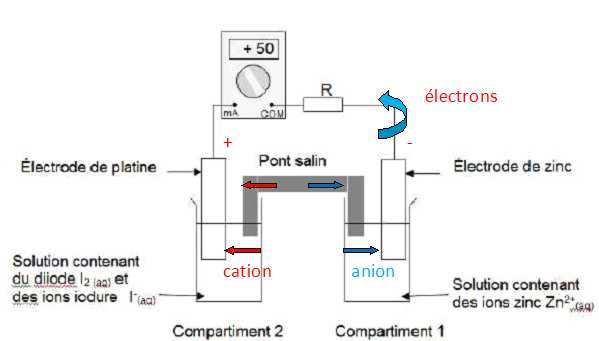
Donner l’expression du quotient de réaction initial Qri et calculer sa valeur. Qri = [I-(aq)]02 [Zn2+(aq)]0 / [I2(aq)]0 =(5,0 × 10-2)2*1,0 × 10-1 / 1,0 × 10-1 = 2,5 10-3. La constante d’équilibre associée à l’équation de la réaction ayant pourréactifs le zinc métal et le diiode en solution aqueuse est K = 1046 à la température T = 25 °C. Prévoir le sens d’évolution spontanée du système chimique constituant la pile. Qri < K, donc évolution spontanée dans le sens direct. Que peut-on dire de l’évolution de la concentration molaire en diiode dans le compartiment 2 lorsque la pile fonctionne ? Justifier à partir de l’expression du quotient de réaction Qr. Lors du fonctionnement de la pile Qr tend vers K : Qr augmente fortement. Qr = [I-(aq)]2 [Zn2+(aq)] / [I2(aq)]. [I-(aq)], [Zn2+(aq)] augmente, [I2(aq)], un réactif, diminue.
Durée de fonctionnement de la pile. On laisse fonctionner la pile pendant la durée Dt. On suppose que l’intensité I du courant débité par la pile reste constante et égale à 50 mA. Pour déterminer la quantité de matière de diiode ayant été consommée pendant le fonctionnement de la pile, on dose le diiode restant dans le compartiment 2 de la pile avec une solution incolore de thiosulfate de sodium (2 Na+ (aq) + S2O32-(aq)) de concentration molaire en soluté apporté C1 = 2,0 × 10-1 mol.L-1. On précise que la couleur brune de la solution du compartiment 2 est due à la présence de diiode, seule espèce colorée mise en jeu. Le volume de solution de thiosulfate de sodium versé à l’équivalence est V1,E = 14,7 mL. L’équation de la réaction servant de support au dosage est : 2S2O32-(aq) + I2(aq) = S4O62-(aq) + 2 I-(aq). Faire un schéma annoté du dispositif expérimental de dosage. 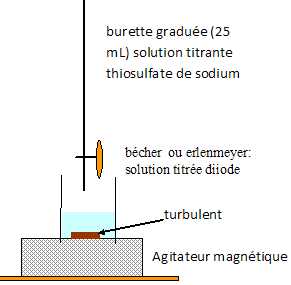 Définir l’équivalence d’un dosage. Comment la repère-t-on ici ? A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès, après l'équivalence, l'autre réactif est en excès. En présence d'empois d'amidon, le diiode donne une teinte violette foncé. l'équivalence est repérée par la disparition de cette couleur. Quantité de matière de diiode consommé. Compléter le tableau d’avancement On note x l’avancement de la réaction de dosage.
n2 -xéq=0 ; n2 = xéq ; de plus n1-2xéq= 0 soit n1=2xéq ; de plus n1=C1V1,E ; par suite n2 = ½C1V1,E = 0,5 *0,20 *14,7 10-3 = 1,47 10-3 ~1,5 10-3 mol. En déduire la quantité de matière ncons(I2) de diiode consommé lors du fonctionnement de la pile. n0(I2) = [I2(aq)]0 V = 0,10 *0,100 = 1,0 10-2 mol. ncons(I2) = n0(I2) - n2 = 1,0 10-2 -1,47 10-3 ~8,5 10-3 mol.
|
||||||||||||||||||||||||||||||
|
|