Eau
oxygénée à 10 volumes.
Pour désinfecter une plaie au genou d'une personne agée, j'ai utilisé
une solution d'eau oxygéne à 10 volumes comme antiseptique. J'ai
observé des marques d'rritation et de brulures.
Le titre, noté T, d'une eau oxygénée est un nombre égal au volume de
dioxygène exprimé en litres que libère un litre de solution d'eau
oxygénée dans les conditions normales de température et de pression.
|
|
L'eau
oxygénée est une solution aqueuse de peroxyde d'hydrogène H2O2.
Le peroxyde d'hydrogène a la particularité d'^tre soit oxydant soit
réducteur. L'eau oxygénée appartient donc à deux couples
oxydant / réducteur.
Pour vérifiier le titre d'une eau oxygénée on réalise un dosage. Cette
eau oxygénée est dosée par une solution de permanganate de potassium de
concentration c1 = 1,0 mol/L. On prélève un
volume V2 = 10 mL d'eau oxygénée.
Compléter
le schéma suivant.
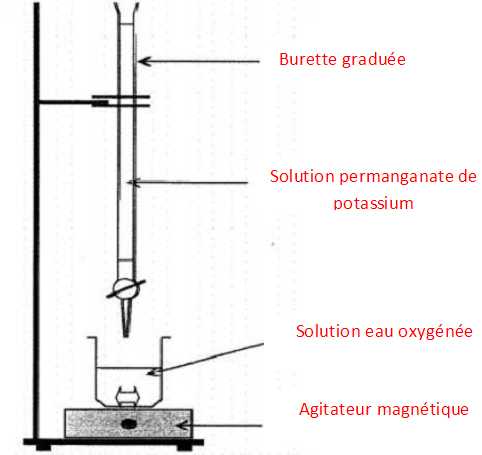
|
.
Les deux couples
oxydant / réducteur utilisés dans ce dosage sont : O2
/ H2O2 et MnO4-
/Mn2+. On donne les demi-équations
d'oxydoréduction :
MnO4- + 8H+
+ 5e- = Mn2+ + 4H2O
(1)
O2
+ 2H+ + 2e- =H2O2
(2)
A partir de ces deux
demi-équations, recopier et compléter l'équation de la réaction du
dosage donnée ci-dessous:
MnO4- + ....H2O2
+.......H+ --> ..... +......+ ........
2 fois (1) : 2MnO4- + 16H+
+ 10e- = 2Mn2+ + 8H2O
5 fois (2) écrire en sens inverse : 5
H2O2 =5O2
+ 10H+ + 10e- .
Ajouter : 2MnO4- + 16H+
+ 10e- + 5 H2O2
= 2Mn2+ + 8H2O
+5O2
+ 10H+ + 10e- .
Simplifier : 2MnO4-
+ 6H+ + 5 H2O2
= 2Mn2+ + 8H2O
+5O2 .
Définir l'équivalence
d'un dosage.
A l'équivalence les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'un des réactifs
est en excès ; après l'équivalence, l'autre réactif est en excès.
A l'équivalence nH2O2 = 2,5 n MnO4-.
On note VE le volume de permanganate de
potassium versé à l'équivalence et c2 la
concentration de la solution d'eau oxygénée.
Etablir
la relation entre c1, c2, V2 et VE à
l'équivalence.
nH2O2 =c2 V2
; n MnO4-= c1 VE
et nH2O2 = 2,5 n MnO4-
d'où : c2 V2
=2,5 c1 VE .
Montrer
que c2 = 2,7
mol/L si VE = 10,8 mL.
c2 =2,5 c1 VE
/ V2 =2,5 *1,0 *10,8 / 10 =2,7 mol/L.
La relation entre le titre T et
la concentration molaire c d'une eau oxygénée est T = 11,2 c.
En
déduire le titre T de la solution d'eau oxygénée.
T = 11,2 *2,7 =30,24 ~30 volumes.
Le
stagiaire a t-il utilisé une solution de mauvais titre qui pourrait
expliquer la brûlure de la personne agée ?
Oui, le titre déterminé expérimentalement est trois fois supérieur à 10 volumes.
|
|
|
