.
|
|
Le jour
de la compétition est enfin arrivé. Lors de la course, notre sportif
est pris de crampes. Après s’être hydraté et après avoir réalisé
quelques étirements, il arrive à terminer son épreuve.
De retour à son lycée, il se documente sur l’origine des crampes et
découvre que c’est la formation puis l’accumulation d’acide lactique au
niveau des muscles qui est en jeu dans ce phénomène.
L’acide lactique sera noté AH. Sa base conjuguée est l’ion lactate noté
A- .
Acide et base.
Énoncer la définition d’un acide selon Brönsted.
Un acide est une espèce, ion ou molécule, susceptible de céder un proton H+.
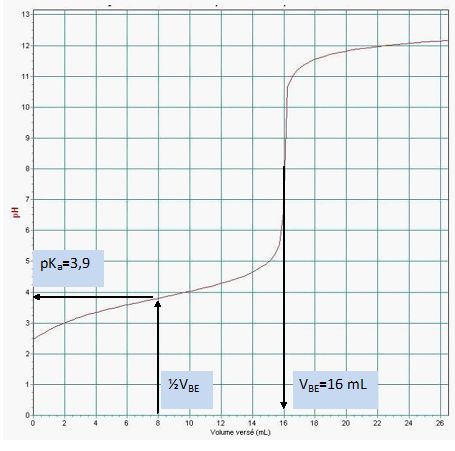
Le pKa de l’acide lactique vaut 3,9.
Représenter sur un axe gradué
en pH, lediagramme de prédominance de l’acide lactique et de l’ion lactate.

Lors d’un effort, le pH du sang vaut 6,9.
En s’aidant du diagramme
précédemmenttracé, quelle est l’espèce prédominante entre l’acide lactique et l’ion
lactate ? Justifier.
A pH= 6,9, supérieur à pKa, l'ion lactate prédomine.
Dosage pH-métrique.
L’élève dose un volume VA = 10 mL d’une solution S d’acide lactique noté AH avec une solution d’hydroxyde de sodium (Na+ + HO-) de concentration CB = 5,0 x 10-2 mol.L-1 et trace la courbe pH = f(VB), VB étant le volume de base versé.
On donne les demi-équations acido-basiques associées aux couples AH/A- et H2O/HO- :
AH = A- + H+ ; H2O = HO- + H+.
En déduire l'équation de la réaction de dosage de l’acide lactique par la base utilisée.
AH +HO- ---> A- + H2O.
Définir l’équivalence d’un dosage acido-basique.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiomètriques. Avant l'équivalence, l'un des réactifs
est en excès, après l'équivalence, l'autre réactif est en excès.
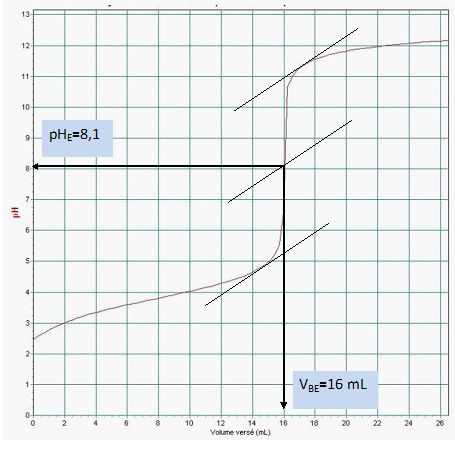
Á l’aide de la courbe donnée, déterminer les coordonnées du point à l’équivalence, soient pHE et VE, volume de la solution d’hydroxyde de sodium versé.
Justifier en faisant apparaître les traits de construction.
|
.
.
Déterminer la concentration CA en acide lactique de la solution étudiée.
On rappelle la relation vérifiée à l’équivalence : CA.VA = CB.VBE.
CA = CB.VBE / VA=0,050 *16 / 10 = 0,080 mol/L.
Déterminer graphiquement le pKa du couple associé à l’acide lactique.
Á défaut de pH-mètre, on peut utiliser un indicateur coloré qui permet de repérer l'équivalence par un changement de couleur. Pour cela, le pH du point équivalent doit
appartenir à la zone de changement de couleur de l'indicateur coloré appelée zone de virage.
Á l’aide du tableau ci-dessous, choisir l’indicateur coloré à utiliser pour ce dosage.
Indicateur coloré
|
zone de virage |
Indicateur coloré |
zone de virage |
Hélianthine
|
3,1 - 4,4
|
Rouge de méthyle
|
4,2 - 6,2
|
Bleu de bromothymol
|
6,0 - 7,6
|
Rouge de crésol
|
7,2 - 8,8
|
Phénolphtaléine
|
8,2 - 10
|
|
|
Le rouge de crésol est le plus approprié : sa zone de virage contient le pH du point équivalent.
|
|
|


