|
|
On ne tiendra pas compte des propriétés acido-basiques de CO2aq.
Un volume de 512 mL de CO2
gazeux a été dissous dans une bouteille d'eau. Celle-ci est débouchée à
la date t=0, la température et la pression sont maintenues constantes.
La solution dégage du CO2. En 2 jours, on recueille 256 mL de CO2 gazeux. De t = 2 jours à t = 4 jours, on en recueille 128 mL. De t = 6 jours à t = 8 jours, on en recueille 64 mL.
Proposer un schéma de principe du montage expérimental permettant de suivre le dégagement gazeux en fonction du temps.
Le dioxyde de carbone étant très peu soluble dans l'eau, on utilise le
montage de récupération d'un gaz par déplacement d'eau ( bouteille muni
d'un tuyau débouchant sur une éprouvette graduée renversée sur un
cristallisoir rempli au 2/3 d'eau ).
Donner l'ordre de la réaction et calculer sa constante de vitesse.
Pression et température étant constantes, le volume de gaz VCO2 est proportionnel à la quantité de matière nCO2.
Le temps de demi-réaction t½ est égal à 2 jours, indépendant de la concentration initiale, l'ordre de la réaction est donc égal à 1 et k = ln2 / t½ = ln2 / 2 = 0,35 jour -1.
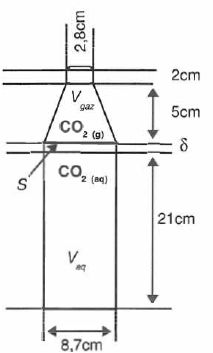
Le modèle étudié peut prendre en compte le fait qu'il existe au
voisinage de l'interface ( dans le liquide ) une zone d'épaisseur d dans laquelle le soluté diffuse. La bouteille est schématisée ci-dessous avec Vaq = 1,25 L et Vgaz = 0,150 L.
On
postule que la vitesse de transfert des molécules de dioxyde de carbone
entre la phase aqueuse et gazeuse est contrôlé par le phénomène de
diffusion des molécules à travers une couche de diffusion d'épaisseur d dans la phase aqueuse. Cette épaisseur d est de l'odre de 100 µm et varie avec l'agitation, considérée comme nulle ici.
On donne les coefficients de diffusion pour le CO2 respectivement dans la phase aqueuse et dans la phase gazeuse :
Daq = 10-9 m2 s-1 ; Dgaz = 10-5 m2 s-1.
|
.
.
|
La transformation est modélisée par :
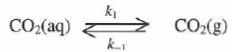
Une modélisation cinétique du dégazage conduit à une expression du type :
-d[CO2aq] / dt = k1[CO2aq]-k-1 PCO2.
Justifier que l'on ne considère pas sune couche de diffusion pour la phase gazeuse.
Daq << Dgaz ; la diffusion d'un gaz dans l'atmosphère est très rapide.
Quelle
est l'influence de l'agitation sur l'épaisseur de la couche de
diffusion ? La surface S est-elle à priori un facteur cinétique ?
L'agitation
homogénéise la solution et diminue l'épaisseur de la couche de
diffusion. En augmentant la surface S, les échanges sont favorisés : S
est donc un facteur cinétique.
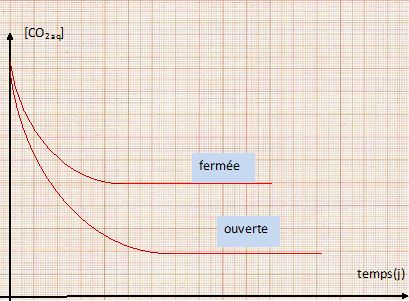
Donner l'allure de la courbe représentative de l'évolution de [CO2aq] en fonction du temps, selon que la bouteille est fermée ou non.
Un traitement physique du problème permet de relier la constante de vitesse k1 au coefficient de diffusion Daq, à la valeur de l'épaisseur de la couche de diffusion, à la surface S et au volume du gaz Vaq.
k1 = Daq S ( d Vaq).
Pourquoi
le dégagement gazeux est-il plus abondant lorsqu'on agite une bouteille
de soda avant de l'ouvrir par rapport à une bouteille non agitée ?
L'agitation diminue l'épaisseur d de la couche de diffusion. La
boisson est dans un état métastable : un état qui ne demande qu'à être
perturbé pour évoluer vers un état beaucoup plus stable.
En secouant la bouteille on provoque l'agitation des bulles déjà présentes et on engendre d'autres bulles.
On ouvre une bouteille neuve non agitée et on la rebouche rapidement.
Evaluer la perte en CO2.
Une bouteille de soda de 1 L contient entre 5 et 8 g de CO2 ; une bouteille de 1,25 L en contient de 6 à 10 g. Cela correspond à : 3 bar < PCO2 bouteille < 5 bar.
De plus PCO2 atmosphère = 3,8 10-4 bar. L'égalisation des pression est donc rapide et on peut négliger le dégazage du liquide.
Perte en CO2 : nCO2 = PCO2 bouteille Vgaz / (RT).
nCO2 mini = 3 105 *0,15 10-3 / (8,34*298) ~0,02 mol ; nCO2 maxi= 5 105 *0,15 10-3 / (8,34*298) ~0,03 mol.
Soit une masse de gaz perdu comprise entre 0,02*44 ~ 0,9 g et 0,03*44 ~1,3 g ( environ 15 % ).
Quelles sont les différents paramètres cinétique et thermodynamique sur lesquels on peut jouer pour dégazer une boisson ?
Facteurs cinétiques : agiter, augmenter S et la température.
Facteurs thermodynamiques : augmenter la température et diminuer la pression.
|
|


