|
|
Détermination qualitative des
sucres présents dans le coca.
Des
élèves ont réalisé une chromatographie sur couche mince du coca-cola.
De gauche à droite, les dépôts sont les suivants :
solution de glucose, solution de fructose, boisson, solution de
saccharose.
L'éluant est un mélange d'acétone, butanone, eau dans les proportions (
40 ; 40 ; 20 ). La plaque a été révélée à l'aide du réactif de
Molisch ( a-naphtol dans
l'acide sulfurique ).
Le chromatogramme
confirme-t-il l'hydrolyse du saccharose ?
Les rapports frontaux du glucose et du saccharose sont proches.
Néanmoins la boisson
contient encore beaucoup de saccharose, une partie a été hydrolysée en
glucose et fructose.
Un autre type d'éluant utilisable est constitué d'un mélange éthanol,
acide éthanoïque, butanone.
Dans le cadre d'un
TP, proposer un scénario permettant de déterminer les proportions
nécessaires à une séparation efficace.
Chaque groupe d'élève teste un éluant constitué des trois solvants en
proportions différentes. On rassemble les résultats afin de trouver
le mélange le plus approprié.
|
|
Détermination de la proportion
massique en sucre.
Les élèves de seconde ont déterminer la masse m de 100 mL de solution
contenant une certaine quantité de sucre ( concentration massique C ).
Les résultats sont rassemblés ci-dessous :
C
(g / L)
|
0
|
200
|
150
|
100
|
50,0
|
25,0
|
12,5
|
m
(g)
|
99,6
|
107,2
|
105,4
|
103,3
|
101,4
|
10,6
|
100,1
|
Les
élèves ont déterminé que la masse de 100,0 mL de liquide de la boisson
dégazée était mboisson = 103,8 g.
Utiliser
le tableau ci-dessus pour obtenir une estimation de la masse de
sucre(s) dissous dans la boisson.
La boisson étant assimilée à une solution sucrée contient environ 100 g
de sucres par litre.
Dosage en retour du glucose dans la boisson.
Dans un premier temps, le protocole est mis en oeuvre sur une quantité de matière de glucose connue :
dans un erlenmeyer de 250 mL, 0,25 g de glucose sont dissous dans de
l'eau distillée, puis un volume de 50,0 mL d'une solution de diiode
étalonnée ( 0,0495 mol/L ) est ajouté. La solution est alcalinisée
jusqu'à décoloration à l'aide de quelques gouttes d'une solution de
soude à 1 mol/L et mise ensuite sous agitation pendant une heure. La
solution est alors acidifiée à l'aide d'acide chlorhydrique à 2 mol/L ;
la couleur brune du diiode réapparaît. Le diiode est enfin dosé par une
solution de thiosulfate de sodium à 0,100 mol/L, la détection du volume
équivalent étant facilité par l'emploi de thiodène ( indicateur de
présence de diiode ). Le volume versé à l'équivalence est Ve0 =20,6 mL.
Par simplification, les propriétés des ions triiodure I3- sont assimilées à celles du diiode.
|
.
.
Analyse des propriétés du diiode en solution aqueuse.
Le
diagramme potentiel-pH simplifié de l'élément iode est fourni
ci-dessous : toutes les activités sont prises égales à 1 sauf celle des
ions H+.
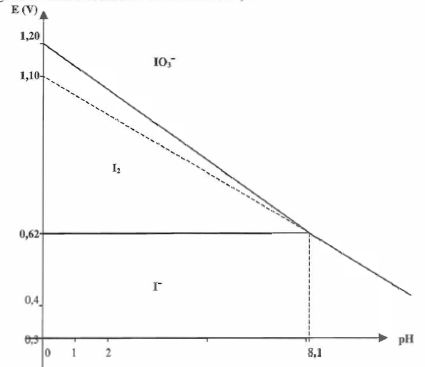
Retrouver la valeur de la pente de la droite frontière correspondant au couple IO3- / I-.
I- + 6HO- = IO3- +3 H2O + 6 e-.
E = E°(IO3- /I- ) +0,01 log([IO3-] / ([I-][HO-]6)) = E°(IO3- /I- ) +0,01 log([IO3-] [H+]6/ ([I-] Ke6)).
E = E°(IO3- /I- ) +0,01 log([IO3-] / ([I-] Ke6)) - 0,06 pH. ( pente -0,06).
Qu'observe-t-on lorsqu'on alcalinise une solution de diiode ? Ecrire l'équation de la réaction.
Le diiode se dismute en I- et IO3- : 3I2 aq + 6HO- aq = 5 I- aq+ IO3-aq +3 H2O.
Quelle
est l'équation de la réaction de titrage du diiode par les ions
thiosulfate ? Calculer la valeur numérique de la constante d'équilibre
à 25°C.
I2 aq + 2S2O32-aq = 2I-aq + S4O62-aq. K = [I-aq]2[S4O62-aq] / ([I2 aq][S2O32-aq]2).
E1= E°(I2 aq /I-aq) + 0,03 log ([I2 aq]/[I-aq]2).
E2= E°(S4O62-aq /[S2O32-aq]) + 0,03 log ([S4O62-aq]/[S2O32-aq]2).
A l'équilibre : E°(I2 aq /I-aq) + 0,03 log ([I2 aq]/[I-aq]2) = E°(S4O62-aq /[S2O32-aq]) + 0,03 log ([S4O62-aq]/[S2O32-aq]2).
E°(I2 aq /I-aq) -E°(S4O62-aq /[S2O32-aq]) = 0,03 log K ; log K = (0,62-0,09) / 0,03 = 17,67 ; K = 4,6 1017.
Le glucose appartient au couple redox acide gluconique (C6H12O7) / glucose (C6H12O6 ).
La valeur Ve0 correspond-elle au volume attendu à l'équivalence ?
Couple I2/I-
: I2 +2e- = 2I-; couple
S4O62-/
S2O32- : 2
S2O32-
=S4O62-+2e-.
I2 +2
S2O32-
=S4O62-+2I-. A l'équivalence :
n(I2)excès =
½
n(S2O32-).
Par soucis de simplification, en milieu
basique, l'équation d'oxydation du glucose R-CHO en
ion gluconate R-COO- peut s'écrire en
faisant intervenir le diiode :
I2 +R-CHO + 3HO- = 2I- +
R-COO- + 2H2O.
Quantité de matière initiale de diiode dans
l'erlenmeyer : V1C1.
Quantité de matière de diiode en
excès : 0,5C2Ve0
Quantité de matière de diiode ayant
réagit avec le glucose libre : n(I2)
=C1V1-0,5C2Ve0.
n(I2) = n(R-CHO).
V1C1 =50*0,0495=2,475 mmol ;
½ C2
Ve0= 0,5*20,6*0,100 =1,03 mmol ; V0 = 50 mL.
n(R-CHO)=2,475-1,03 = 1,445
mmol.
( masse : n(R-CHO) M(glucose) = 1,445*180=260 mg ~0,26 g). Résultat cohérent avec le texte.
On souhaite
déterminer la quantité de glucose contenue dans une boisson, ainsi que
la quantité de sacharose en mettant en oeuvre ce protocole. Dans ces
conditions on indique que le saccharose et le fructose ne sont pas des
sucres réducteurs et que la coloration de la boisson de départ ne gène
pas la détection du volume équivalent.
Proposer
les étapes d'un protocole permettant de déterminer la quantité de
glucose libre dans la boisson ainsi que la quantité de saccharose totale.
|
Solution S0,
concentration C0 : 10,0 mL de jus d'orange est
dilué dans une fiole jaugée de 50,0 mL.
Oxydation du glucose libre : dans un
erlenmeyer mettre 20,0 mL de S0, 25,0 mL de
diiode ( C1 =5,0 10-2 mol/L) ; 5 mL de
solution tampon pH=10.
Titrage de l'excès de diiode
: ajouter 5 mL d'acide chlorhydrique à 2 mol/L,
titrer par le thiosulfate de sodium à C2 =
5,0 10-2 mol/L. On trouve Véq =
24,2 mL.
Solution S'0
, ajouter 5
mL d'acide chlorhydrique ( 2 mol/L) au contenu d'une ampoule
de jus d'orange pour bébé. Chauffer à
reflux durant 30 min.Ajouter 5 mL de soude à 2 mol/L afin que le pH de
la solution soit sensiblement neutre. Transvaser dans une
fiole jaugée de 50,0 mL et compléter avec de
l'eau distillée. Titrer comme ci-dessus 20 mL de
S'0.
Afin
de titrer le glucose total contenu dans l'ampoule de jus
d'orange on procède à l'hydrolyse acide du
glucose.
En
milieu acide et à chaud, le saccharose s'hydrolyse en
glucose et fructose.
|

