|
|
La
valeur énergétique d'une boisson est due aux sucres présents.
Ainsi 1 g de sucre correspond en moyenne à 17 kJ ou 4 kcal ce qui
explique qu'on trouve souvent 4,25 comme facteur lorsqu'on passe d'une
unité à l'autre. ( Ici 181 / 42,6 ).
Donner la définition de la calorie. Retrouver sa valeur précise en joule. Cp(eau ) = 75,3 J K-1 mol-1.
L'énergie nécessaire pour élever de 1°C la température d'un gramme
d'eau ( de 14,5 °C à 15,5 °C sous la pression atmosphérique
normale ) est égale à une calorie.
1 cal = Cp(eau ) / M(eau) Dq =75,3 /18,0 *1 = 4,18 J.
Comment le chimiste modèlise-t-il la transformation du sucre dans le corps pour traduire la production d'énergie ?
Réaction de combustion du glucose :
C6H12O6 aq+ 6O2 (g)= 6 CO2(g) + 6 H2O(l).
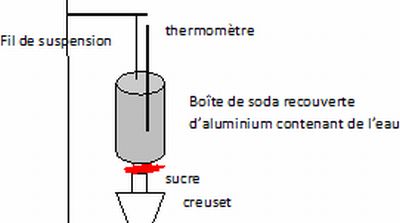
Proposer
en quelques lignes et à l'aide d'un schéma, une expérience permettant
de mettre en évidence, en classe de seconde, la capacité énergétique du
sucre et une évaluation de la calorie.
Brûler du sucre dans le but de chauffer une masse d'eau connue ; mesurer l'augmentation de la température de l'eau.
Il faut travailler rapidement afin que l'énergie produite ne serve pratiquement qu'à chauffer l'eau ( processus adiabatique).
neau Cp (eau) Dq = nsucre fois capacité énergétique molaire du sucre.
n(sucre) = masse du sucre / masse molaire du sucre.
|
.
.
A l'aide des données thermodynamiques, évaluer le pouvoir calorifique du glucose.
DfH° (glucose solide ) = -1262,2 kJ/mol ; DfH° (CO2(g) ) = -393,7 kJ/mol ; DfH° (eau liquide ) = -286,0 kJ/mol.
C6H12O6 (s)+ 6O2 (g)= 6 CO2(g) + 6 H2O(l).
DrH° = 6DfH° (CO2(g) ) +6 DfH° (eau liquide )- DfH° (glucose solide )
DrH° = 6 (-393,7) + 6 (-286,0) -(-1262,2) =-2816 kJ/mol ou -2816 / 180 = -15,6 kJ / g.
La boisson contenant 10,6 g de sucre assimilé au glucose a une valeur énergétique égale à : 15,6 *10,6 ~166 kJ.
Un morceau de sucre ( saccharose) pèse 6,0 g.
Sachant que :
- la réaction d'hydrolyse fournit 15 kJ par mole de saccharose
- seule le glucose est utilisé par le sang
- la combustion d'une mole de glucose fournit 2815 kJ.
Calculer la valeur énergétique d'un morceau de sucre.
La valeur usuelle tabulée est de 24 kJ. Comparer et conclure.
Proposer une correction.
L'hydrolyse d'une mole de saccharose conduit à une mole de glucose et à une mole de fructose.
masse molaire du glucose C6H12O6 : M = 180 g/mol.
Energie fournie par la combustion du morceau de sucre : 2815 *6,0 / 342 = 49,4 kJ.
Energie fournie par l'hydrolyse de 6 g de saccharose : 15 / m(saccharose) = 15 / 342 = 0,044 kJ
Energie totale disponible ( valeur énergétique du sucre ) : 49,4 + 0,044~49,4 kJ ou 49,4 / 4,18 ~ 12 kcal.
L'écart relatif reste grand : (24-12) / 24 = 0,50 ( 50 %).
En fait le fructose est aussi métabolisé et l'énergie produite est voisine de celle du glucose. On retrouve bien 24 kcal.
|
.
|
