|
.
|
|
Quelles
expériences de cours le professeur peut-il réaliser et quelles
synthèses industrielles peut-il citer, pour illustrer les trois type de
catalyse et montrer la sélectivité d'un catalyseur ?
Expériences :
Catalyse homogène :
- Dismutation de l'eau oxygénée en présence d'ion Fe3+.
- Estérification en milieu acide.
- Hydratation d'un alcène en alcool en présence d'acide sulfurique.
Catalyse hétérogène :
- Dismutation de l'eau oxygénée en présence de platine.
- L'iode et l'aluminium donne en présence d'eau du triodure d'aluminium.
Catalyse enzymatique :
- Dismutation de l'eau oxygénée en présence d'une goutte de sang.
- Fermentation alcoolique du glucose en ajoutant de la levure de bière.
Synthèses industrielles :
- Passage de l'éthylène en alcool éthylique ( catalyseur : acide sulfurique ou phosphorique )
- Synthèse de l'ammoniac ( catalyseur : fer ).
Sélectivité d'un catalyseur :
- L'alcool éthylique donne de l'éthanal en présence de
cuivre vers 250 °C et de l'éthylène en présence d'alumine vers
400 °C.
- Un alcyne conduit à l'alcane en présence de nickel et à l'alcène en présence de palladium.
En TP, le professeur propose à ses élèves de réaliser l'expérience suivante :
Dans un erlenmeyer propre
et sec de 100 mL, placer 20,0 mL d'une solution d'eau oxygénée à 20
volumes et 3,0 g de tartrate de sodium dissous préalablement dans 50,0
mL d'eau distillée.
Placer l'erlenmeyer sur une plaque chauffante, tièdir la solution et la placer sous agitation magnétique.
A l'aide d'une pipette
jaugée, verser dans la solution lorsque sa température est de l'ordre
de 45 °C, 5,0 mL d'une solution de chlorure de cobalt (II) à 40 g
/ L.
Observer et noter les modifications qui se produisent dans l'erlenmeyer au cours du temps.
Répondre aux questions suivantes :
Ecrire les équations des couples d'oxydo-réduction H2O2 / H2O et CO2 / C4H4O62- ( ion tartrate).
Ecrire l'équation de la réaction qui modèlise la transformation chimique qui se produit dans le milieu réactionnel.
5 fois { H2O2 aq+ 2H+aq + 2e- = 2 H2O(l) }.
C4H4O62- aq+ 2 H2O(l) = 4 CO2 (g) + 8H+ aq + 10e-.
C4H4O62- aq+ 5 H2O2 aq+ 2H+ aq= 4 CO2(g) + 8 H2O(l).
Quelle est la nature du dégagement gazeux qui se produit dans le milieu réactionnel ? CO2.
Les ions cobalt (II) on une couleur rose en solution aqueuse et les ions cobalt (III) ont une couelur verte.
Expliquer les changements de couleur observés au cours de l'expérience réalisée.
Initialement la solution contient des ions cobalt (II) ( teinte rose ).
Ces derniers sont oxydés en ion cobalt (III) et la couleur rose
disparaît tandis que la teinte verte apparaît. En fin de réaction le
catalyseur est régénéré et la couleur verte disparaît au profit de la
teinte rose.
En quoi l'expérience réalisée permet-elle d'expliquer le principe de fonctionnement d'un catalyseur en catalyse homogène ?
- Le dégagement de gaz n'apparaît quen présence d'ion cobalt (II).
- Le catalyseur participe à la transformation chimique ( disparition de la teinte rose).
- Le catalyseur est régénéré en fin de transformation ( réapparition de la couleur rose ).
Une réaction lente est remplacée par deux réactions rapides.
Oxydation de Co2+ aq : 2Co2+ aq + H2O2aq + 2H+aq = 2Co3+aq + 2H2O(l).
Suivie de la réduction de Co3+aq :
C4H4O62- aq+ 10 Co3+aq + 2 H2O(l)= 4 CO2(g) +10 Co2+ aq+ 8 2H+ aq.
Les ions tartrates font penser à un scientifique français célèbre.
Quel est son nom ? A quelle époque a t-il vécu ? Pour quels travaux est-il connu ?
L. Pasteur né en 1822.
Découverte de la stéréochimie ; pasteurisation des bières ; étude des
maladies infectieuses et mise au point du vaccin contre la rage.
|
L'évolution d'un système chimique peut être modifié par changement d'un réactif ou par l'utilisation d'un catalyseur.
Indiquer comment expliquer à des élèves la différence entre ces deux méthodes.
L'estérification d'un alcool primaire à partir d'un acide carboxylique
en proportions stoechiométriques conduit à un équilibre. ( taux
d'avancement : 0,67 ).
L'estérification d'un alcool primaire à partir d'un anhydride d'acide
en proportions stoechiométriques conduit à une réaction totale. ( taux
d'avancement : 1 ).
L'anhydride d'acide accèlère la réaction et modifie l'état final ; c'est un réactif qui disparaît, sans être régénéré.
Un catalyseur ne modifie pas la composition de l'état final : il
permet d'y arriver plus rapidement. Etant régénéré, il n'apparaît pas
dans le bilan.
Cinétique de l'isomérisation d'un complexe du cobalt.
On s'intéresse à deux complexes formés avec l'éthylènediamine ou 1,2-diaminoéthane H2NCH2-CH2NH2, noté en et les ions chlorures, de formule [Co(en)2Cl2]+.
Ecrire la structure électronique des ions Co3+ dans l'état fondamental. Z =27.
Co3+ : 1s²
2s2 2p6 3s2 3p6
3 d6.
Expliquer pourquoi l'éthylène diamine est un ligand.
Les deux doublets libres des deux atomes d'azote peuvent établir deux liaisons de coordination avec l'ion cobalt(III).
Il existe plusieurs complexes [Co(en)2Cl2]+ de géométrie octaèdrique ; l'un est trans, deux autres sont cis.
Donner
une représentation spatiale du complexe trans et d'un complexe cis en
utilisant le formalisme de Cram. Donner la relation de stéréo-isomérie
entre eux. Indiquer si ces complexes sont chiraux. Justifier brièvement.
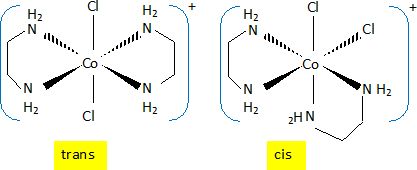
Les isomères cis et rans sont des diastéréoisomères.
L'isomère trans possèdant un plan de symétrie, n'est pas chiral ;
l'isomère cis, n'étant pas superposable à son image dans un miroir est
chiral.
On étudie l'isomérisation dans le méthanol d'un complexe cis noté C, en
complexe trans, noté T. La transformation est suivie par la mesure de
l'absorbance de la solution à la longueur d'onde l = 539 nm.
Protocole :
Dans un erlenmeyer de 200 mL surmonté d'un réfrigérant à air, chauffer 100 mL de méthanol à 40 °C grâce à un bain thermostaté.
Dissoudre 56 mg de solide [Co(en)2Cl2] Cl cis et déclencher le chronomètre ( la dissolution totale peut prendre quelques minutes ).
Suivre l'évolution de l'absorbance en prélevant des échantillons de la solution.
Entre la première et la
deuxième mesure, prélever environ 20 mL de la solution et la porter à
reflux à l'aide d'un montage approprié pendant environ 45 minutes ( la
solution doit être franchement verte ).
Mesurer alors son absorbance à la même longueur d'onde.
Les résultats obtenus sont les suivants :
t(min)
|
5
|
10
|
20
|
25
|
30
|
38
|
46
|
53
|
60
|
65
|
infini
|
A
|
0,131
|
0,127
|
0,120
|
0,117
|
0,113
|
0,108
|
0,104
|
0,100
|
0,096
|
0,094
|
0,024
|
Au vu des spectres d'absorption donnés ci-après, des complexes C et T
obtenus pour une même concentration en complexe dans le méthanol, justifier le choix de la longueur d'onde.
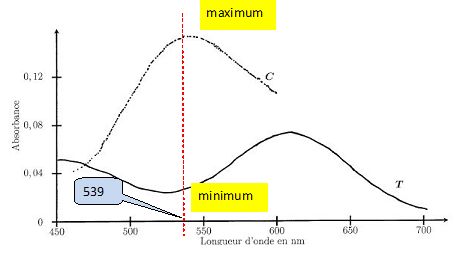
A la longueur d'onde choisie, seul le complexe cis présente un maximum
d'absorption. De plus à une petite variation de la longueur d'onde,
correspond un faible variation de l'absorbance.
Nommer la loi donnant l'absorbance en fonction des concentrations des espèces chimiques. Seuls les complexes C et T absorbent à la longueur d'onde choisie.
Loi de Beer-Lambert : A= log (I0/I) =
elc
( A est
l'absorbance
ou densité
optique).
Cette loi est vérifiée lorsque la solution
est de concentration inférieure à : c < 0,1
mol.L-1.
e
(L mol-1
cm-1) est une caractéristique
de la molécule ( coefficient d'absorption molaire ). Plus e
sera grand, plus la solution absorbe.
l est
l'épaisseur de la cuve
(cm) et
c la concentration de la solution
(mol/L).
Absorbance et concentration étant
proportionnelles, cette relation peut être
utilisée pour réaliser des dosages ou des
suivis cinétiques.
Dans ce cas A = ec l Cc + eT l CT.
Indiquer les réglages à réaliser avant de commencer les mesures.
Faire le blanc : régler à zéro l'absorbance d'une cuve contenant la solution de méthanol, le solvant.
Les mesures ultérieures correspondront à l'absorbance de C et T.
Expliquer le rôele du chauffage .
" et la porter à reflux à l'aide d'un montage approprié pendant environ 45 minutes "
La température est un facteur cinétique, l'état final sera plus vite obtenu.
Montrer
que les résultats expérimentaux sont en accord avec une
transformation totale modélisée par une réaction d'ordre un par rapport
à C. Indiquer la valeur de la constante de vitesse k.
v = -dCc/dt = kCc ; dCc / Cc = -kdT ; intégrer : ln Cc = -kt + constante.
A t = 0, Cc = C0 d'où : ln (Cc / C0) = -kt.
A0 = ec l C0 ; A = ec l Cc + eT l CT ; Aoo = eT l C0 ;
Conservation de l'élément cobalt : C0 = Cc +CT ; A = ec l Cc + eT l (C0 - Cc) =(ec-eT) l Cc + eT l C0 d'où : (ec-eT) l Cc = A -Aoo ;
De plus : A0 -Aoo =(ec-eT) l C0 ; (ec-eT) l = (A0 -Aoo ) d'où : Cc / C0 =(A -Aoo) / (A0 -Aoo )
ln (Cc / C0) = ln ((A -Aoo) / (A0 -Aoo )) = -kt.
On trace la courbe d'équation : ln (A -Aoo) = -kt + ln(A0 -Aoo ) ; il s'agit d'une droite de pente égale à -k.
t(min)
|
5
|
10
|
20 |
25
| 30
|
38
|
46
|
53
|
60
|
65
|
infini
|
| ln(A -Aoo) |
-2,23
|
-2,27
|
-2,34
|
-2,38
| -2,42
|
-2,48
|
-2,53
|
-2,58
|
-2,63
|
-2,66
|
xx
|
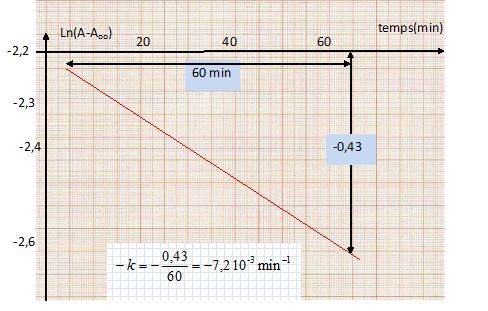
Les résultats expérimentaux confirment l'hypothèse d'une cinétique d'ordre un par rapport à C.
|
|


