|
.
|
|
Les
éléments nickel et hydrogène.
Un atome d'hydrogène peut perdre un électron pour former l'ion
hydronium H+ ou gagner un électron pour former
l'ion hydrure H-.
Donner le
numéro atomique des ions H+ et H-.
Z = 1.
Donner un
autre nom pour l'ion hydronium. Oxonium.
Qu'est-ce
qu'un isotope ? Donner le nom d'un isotope de l'hydrogène.
Deux isotopes ont le même numéro atomique ; ils ne différent que par
leur nombre de neutrons.
Le deutérium, le tritium sont des isotopes de l'hydrogène.
L'ion tétrahydruroborate BH4-
peut être considéré
comme un donneur d'ion hydrure en chimie organique. D'autres espèces
peuvent être considérées comme des donneurs d'ion H+.
Donner la
configuration électronique fondamentale de l'atome de bore.
Z = 5.
1s2 2s2 2p1.
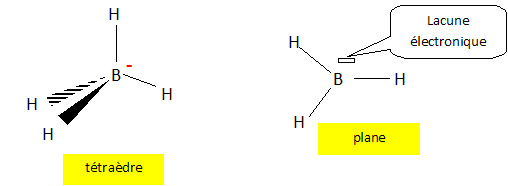
Donner
le schéma de Lewis et la géométrie de l'ion tétrahydruroborate.
Comment
appelle -t-on les espèces capables de donner un ion hydronium H+
? Des acides.
Le dihydrogène est un gaz à 25°C et sous 1 bar.
Comment
prépare-t-on industriellement le dihydrogène ?
Vaporeformage catalytique du gaz naturel.
Comment
le prépare-t-on au laboratoire ? Comment caractériser sa formation
?
Action d'un acide sur un métal ( acide chlorhydrique + zinc ).
On approche une bûchette enflammée
d'un tube à
essai contenant du dihydrogène. Il se produit un bruit caractéristique
appelé « jappement » ou « aboiement ».
Citer
une application industrielle de ce gaz.
Production d'ammoniac, de méthanol, hydrogénation des graisses et des
huiles.
|
Le
nickel métal est décrit en cristallographie par un réseau cubique à
faces centrées avec un paramètre de maille a = 351 pm. L’aluminium est
aussi décrit par un réseau
cubique à faces centrées.
Représenter
une maille cubique conventionnelle du nickel en utilisant un modèle
éclaté (les atomes de métal seront représentés par de gros
points).
Représenter
une face du cube précédent en assimilant les atomes de nickel à des
sphères de rayon métallique RNi
? On indiquera clairement le contact des atomes.
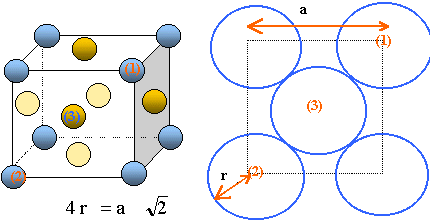
Il y a contact des sphères suivant la diagonale d'une
face du cube.
Donner
la relation entre le paramètre de maille a et le rayon métallique RNi puis
calculer RNi.
2½a = 4 RNi ; RNi
=2½a/4 =1,414*351/4 =124,097 ~124 pm.
Le rayon métallique de l’aluminium est RAl = 143
pm.
Prédire
à quelle famille d’alliage appartient le nickel de Raney qui est un
alliage Ni/Al.
Le rayon métallique de l'auminium est trop grand pour que l"aluminium
occupe un site octaèdrique ou tétraèdrique ; les rayons métalliques de
l'aluminium et du nickel étant assez proches, l'aluminium peut prendre
la place du nickel : alliage de substitution.
Les
alcènes.
On donne ci-dessous les propriétés physiques de quelques alcènes CnH2n+1-CH=CH2.
| alcène |
température
d'ébullition
sous 1 bar |
densité
à 20°C |
| éthène |
-104°C |
0,97 |
| propène |
-48°C |
1,48 |
| but-1-ène |
-6°C |
1,93 |
| pent-1-ène |
30°C |
0,64 |
| hex-1-ène |
63°C |
0,67 |
| hept-1-ène |
95°C |
0,70 |
Proposer
une explication pour l'évolution de la température d'ébullition des
alcènes en fonction de n.
La
température d'ébullition augmente avec la masse molaire et avec la
longueur de la chaîne carbonée. Les forces de London augmentent avec la
longueur de la chaîne carbonée.
Proposer
une explication pour l'anomalie d'évolution de la densité située entre
le but-1-ène et le pent-1-éne.
A 20°C sous 1 bar , l'éthène, le propène, le bu-1-ène sont gazeux alors qu'à partir du pent-1-ène, les alcènes sont liquides.
L'énergie de la liaison à 25°C de la
liaison simpleC-C vaut EC-C = 346 kJ/mol et
celle de la liaison double C=C vaut EC=C =602
kJ/mol.
Pourquoi
a-t-on EC=C différent de EC-C
?
La liaison double est constituée de deux liaisons de type différent :
une liaison sigma et une liaison pi ( plus faible qu'une liaison sigma ).
Les enthalpies standard d'hydrogénation à 25°C des butènes sont données
ci-dessous :
| butène |
but-1-ène |
(E) but-2-ène |
(Z) but-2-ène |
| enthalpies standard d'hydrogénation
(kJ/mol) |
-125,7 |
-114,6 |
-118,9 |
Donner le
nom d'un autre isomère du butène. (non cité dans le tableau )
2-méthylpropène (CH3)2C=CH2.
Identifier
les relations d'isomérie entre les butènes cités dans le tableau.
(E)
but-2-ène et (Z) but-2-ène : diastéréoisomères de type Z E.
but-1-ène et (E) but-2-ène : position différente de la fonction dans le
squelette carboné.
Comparer
la polarité du (E) but-2-ène et du (Z) but-2-ène.
Le (E) but-2-ène possède un centre de symétrie, la molécule n'est pas
polaire.
Le
(Z) but-2-ène possède seulement un plan de symétrie : la molécule est
polaire.
Que
représente physiquement l'enthalpie standard d'hydrogénation
?
L'enthalpie
standard d'hydrogènation permet de déterminer l'accroissement de
stabilité d'un système conjugué par rapport à une structure non
conjuguée.
Donner
un test caractéristique de la liaison C=C.
Une molécule possèdant une double liaison carbone carbone ( alcène ) décolore
une solution de dibrome : ce dernier s'additionne sur la liaison double.
Le nickel de Sabatier.
On donne R = 8,31 J K-1 mol-1.
Grandeurs thermodynamiques à 298 K.
| NiO(s) | H2(g) | Ni(s) | H2O(g) | | enthalpie standard de réaction (kJ/mol) | -239,7 | 0 | 0 | -241,2 | | entropie molaire standard ( J K-1 mol-1) | 38,0 | 130,6 | 29,9 | 187,9 |
Le
nickelde Sabatier est obtenu en deux étapes :on chauffe le carbonate de
nickel ( réaction 1) puis on réduit l'oxyde de nickel par le
dihydrogène gazeux à 573 K ( réaction 2).
NiCO3(s) = NiO(s) + CO2(g). DrH° (298 K) = 46,8 kJ / mol.
NiO(s) + H2(g) = Ni(s) + H2O(g).
Quelle est l’influence d’une augmentation de la température à pression constante sur l’équilibre de la réaction 1 ? Un raisonnement qualitatif est attendu.
DrH°
(298 K) est positif : la réaction est endothermique. Une augmentation
de température à pression constante, déplace l'équilibre dans le sens
direct.
Quelle est l’influence d’une augmentation de la pression à température constante sur l’équilibre de la réaction 1 ? Un raisonnement qualitatif est attendu.
Evolution
dans le sens d'une diminution de la pression, donc diminution du nombre
de molécules de gaz : évolution dans le sens indirect.
Quelle est l’influence d’un ajout d’oxyde de nickel à température et pression constante sur l’équilibre de la réaction 1 ? Un raisonnement qualitatif est attendu.
Le quotient de réaction ne dépend pas des quantités de matière des solides. l'équilibre n'est pas modifié.
Calculer la valeur de l’enthalpie standard de réaction DrH° (298 K) à 298 K pour la réaction 2.
DrH° (298 K) = DfH° (H2O(g)) + DfH° (Ni(s))- DfH° (H2(g)) -DfH° (NiO(s))
DrH° (298 K) = -241,2 -(-239,7) = -1,5 kJ / mol.
Calculer la valeur de l’entropie standard de réaction DrS°(298 K) à 298 K pour la réaction 2.
DrS°(298 K) =S° (H2O(g)) + S° (Ni(s))- S° (H2(g)) -S° (NiO(s)).
DrS°(298 K) = 187,9 + 29,9 -130,6 -38,0 = 49,2 J K-1 mol-1.
Rappeler l’hypothèse d’Ellingham puis utiliser cette hypothèse pour calculer la valeur de l’enthalpie standard de réaction DrH°(573 K) et la valeur de l’entropie standard de réaction DrS°(573 K) à 573 K.
On se place dans le cadre de l'approximation
d'Ellingham : DrH° et DrS° ne dépendent pas de la température.
DrH° (298 K) = DrH° (573 K) =-1,5 kJ / mol.
DrS° (298 K) = DrS° (573 K) = 49,2 J K-1 mol-1.
Calculer la valeur de l’enthalpie libre standard DrG°(573 K) à 573 K pour la réaction 2. En déduire la valeur de la constante d’équilibre K°(573 K) pour la réaction 2.
DrG°(573 K) = DrH° (573 K) -T DrS° (573 K).
DrG°(573 K) = -1,5 103-573*49,2 = -2,97 104 J mol-1.
DrG°(573 K) = -RT ln K ; ln K = DrG°(573 K) /( -RT ) = -2,97 104 / (-8,31*573) =6,24 ; K =511,51 ~ 5,1 102.
Déterminer les valeurs de pressions partielles en dihydrogène H2(g) et eau H2O(g) à l’équilibre (réaction 2) à 573 K pour une pression totale P= 1,5 bar.
K = PH2O / PH2 avec PH2O pression partielle de la vapeur d'eau et : PH2 pression partielle du dihydrogène.
A partir de n mole de dihydrogène : il y a à l'équilibre xéq mole d'eau et n-xéq mole de dihydrogène. Nombre total de moles de gaz : n.
PH2O = xéq / n P ; PH2 = (n-xéq)/ n P = P-PH2O.
K = PH2O / PH2 = PH2O / ( P-PH2O ) ; K ( P-PH2O ) =PH2O ; PH2O = KP / (K+1) =511,51*1,5 / 512,51 = 1,49707~ 1,5 bar.
PH2 =P-PH2O = 1,5 -1,49707 =2,927 10-3~ 2,9 10-3 bar.
|
|

