|
La pile à combustible : concours EMCTA 2010. |
||||||||
|
||||||||
|
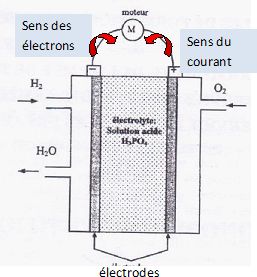
la NASA. Ces piles alimentaient en électricité les ordirnteurs de bord des vaisseaux Gemini el Appolo et fournissaient l'eau de consommation. En effet, par compraison avec piles salines et alcalines, les piles à combustible, type hydrogène oxygène, présentent des avantages : faire appel à des réactifs (dioxygène de l'air et dihydrogène) disponibles en grande quantié et ête non polluantes eu libérant de l'ean. Le principe de fonctionnement est simple : la cellule de réaction est composée de deux éleclrodes séparées par un électrolyte (exemple : l'acide phosphorique H3PO4 ). Elle est alimentée en dihydrogène et en dioxygène en continu.
Dans la navette spatiale, les piles à combustible utilisées débitent un courant d'intensité I = 200 A. Donner l'expression de la charge électrique Q libérée pendant une durée t. Q = I t avec I (A), t(s) et Q(C). En déduire la quantité de matière np, calculée en moles des porteurs de charges ayant circulé dans le circuit pendant 24 heures. Q = np F = I t ; np = I t / F avec F = 96500 C mol-1. Calculer alors la quantité de matière n(H2) et le volume v(H2) de dihydrogène consommé en 24 heures. (On prendra un volume molaire Vm = 24 L.mol-1). Aide : 48*36/965 = 1,79 np =200*24*3600/96500 = 100*2*24*36/965 = 100*1,79 = 179 moles. H2(g) = 2H+aq +2e- : n(H2) = ½np =179/2 =89,5 moles. v(H2) = n(H2) Vm =89,5*24 =2148 L ~2,1 m3.
|
||||||||
|
|
||||||||