|
.
|
|
Généralités sur la chromatographie.
Rappelez le principe de toute méthode chromatographique.
La chromatographie est une
méthode de séparation et d'identification des
constituants d'un mélange.
La chromatographie est basée
sur la différence de solubilité d'une
substance dans deux phases non miscibles:la phase
stationnaire liée au support et la phase mobile ou
solvant.
Plus une substance est soluble dans
la phase mobile, plus elle est entraînée par
cette phase; inversement, une substance peu soluble dans la
phase mobile migre peu.
Un fluide appelé phase
mobile parcourt un tube appelé colonne. Cette colonne
peut contenir des "granulés" poreux (colonne remplie)
ou être recouverte à l'intérieur d'un
film mince (colonne capillaire). Dans les deux cas, la
colonne est appelée phase stationnaire.
A l'instant initial, le
mélange à séparer est injecté
à l'entrée de la colonne où il se dilue
dans la phase mobile qui l'entraîne à travers
la colonne. Si la phase stationnaire a été
bien choisie, les constituants du mélange,
appelés généralement les
solutés, sont inégalement retenus lors de la
traversée de la colonne.
De ce phénomène
appelé rétention il résulte que les
constituants du mélange injecté se
déplacent tous moins vite que la phase mobile et que
leurs vitesses de déplacement sont
différentes. Ils sont ainsi élués de la
colonne les uns après les autres et donc séparés.
Un détecteur placé
à la sortie de la colonne couplé à un
enregistreur permet d'obtenir un tracé appelé
chromatogramme. En effet, il dirige sur un enregistreur un
signal constant appelé ligne de base en
présence du fluide porteur seul ; au passage
de chaque soluté
séparé il conduit dans le temps à
l'enregistrement d'un pic.
Dans des conditions
chromatographiques données, le "temps de
rétention" (temps au bout duquel un composé
est élué de la colonne et
détecté), caractérise qualitativement
une substance. L'amplitude de ces pics, ou encore l'aire
limitée par ces pics et la prolongation de la ligne
de base permet de mesurer la concentration de chaque
soluté dans le mélange
injecté.
C'est en jouant sur la nature de
l'éluant (et dans une moindre mesure sur la nature du
support) que l'on parvient à séparer les
constituants d'un mélange.
Quels sont les phénomènes mis en jeu dans le cas d’une chromatographie d’adsorption ? De partage ?
La chromatographie de
partage :
Elle est basée sur la différence de solubilité du soluté dans la phase mobile et la phase stationnaire
C'est une chromatographie
liquide-liquide. La phase stationnaire est un liquide
fixé sur un support inerte. Cette chromatographie est
ainsi dénommée car elle est basée sur
le partage du soluté dans les deux phases liquides ( Chromatographie
d'adsorption :
C'est une chromatographie
liquide-solide. La phase stationnaire est un adsorbant
solide polaire.
- La chromatographie d'adsorption
en phase inverse :
C'est une chromatographie
liquide-solide dans laquelle la phase stationnaire est
apolaire.
Citez un exemple de phase stationnaire utilisée en chromatographie d’adsorption et en chromatographie de partage.
La phase stationnaire est un solide à grand pouvoir d'adsorption
: oxyde d'aluminium, les silicates de magnésium, les gels de silice.
Chromatographie
de partage liquide liquide : la phase stationnaire est très fine couche
de liquide adsorbé sur un solide inerte. Groupements silanols polaires
( phase normale ) ou greffons akyles apolaires ayant de 8 à
18 atomes de carbone ( phase inverse ).
|
| .
. |
Analyse de conservateurs présents dans un produit cosmétique.
On cherche à analyser par chromatographie en phase liquide ou HPLC trois conservateurs :
- l’acide para-hydroxybenzoïque ; - le para-hydroxybenzoate de méthyle - le para-hydroxybenzoate d’éthyle.
Les conditions d’analyse retenues sont les suivantes :
- colonne C18, 4x125 mm ; - éluant : mélange 70% A et 30% B avec : - A = H2O, 0.1 % d’acide trifluoroacétique B = acétonitrile,
- débit phase mobile 1 mL/min ; - détecteur UV-visible 254 nm - boucle d’injection 10 mL.
Donnez les formules semi-développées de ces trois composés.
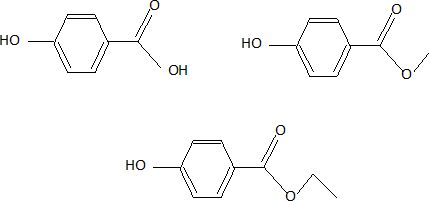
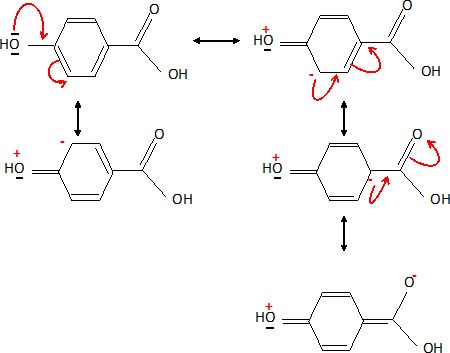
Donnez les formes mésomères de l’acide para-hydroxybenzoïque.
Que signifie le terme C18 de la phase stationnaire ?
les groupes alkyles greffés sur la phase stationnaire comptent 18 atomes de carbone.
Quel est le rôle de l’acide présent dans la phase mobile ?
En milieu basique, le phénol se trouverait sous la forme d'ion
phénolate, l'acide carboxilique serait en partie sous forme d'ion
carboxylate et les esters pourraient être en partie saponifiés.
Le milieu acide évite ces réactions.
Prévoir en le justifiant l’ordre d’élution de ces composés. Quel type d’interaction assure leur séparation ?
La phase stationnaire est apolaire ; la phase mobile est polaire : les espèces les plus polaires migrent le plus vite.
Dans l'ordre, du plus rapide au moins rapide : acide
parahydroxybenzoïque, parahydroxybenzoate de méthyle,
parahydroxybenzoate d'éthyle.
Interaction électrostatique dipôle dipole, liaisons hydrogène.
Les temps de rétention obtenus sont trop longs : comment modifier l’éluant pour diminuer ces temps de rétention ?
Modifier la polarité de l'éluant.
HPLC : élution graduée :
sur une colonne apolaire, en utilisant une phase
mobile eau/méthanol, les composants les plus hydrophobes sont élués avec une
concentration élevée en méthanol alors que les composants plus hydrophiles sont
élués préférentiellement avec une concentration faible en méthanol.
Vous souhaitez dans les conditions décrites précédemment quantifier ces trois conservateurs dans un shampooing :
– en quoi les conditions chromatographiques décrites permettent-elles d’envisager d’effectuer un étalonnage externe ?
On injecte successivement un volume V constant d’une solution étalon (concentration en élément à doser connue Cref) et la solution à doser (concentration inconnue Ci). Comparer les chromatogrammes pour en déduire la concentration.
Créf = k Aréf ; Ci = k Ai ; Ci =Créf Ai / Aréf avec A : aire du pic.
Le spectre IR du para-hydroxybenzoate de méthyle est représenté ci-dessous ; retrouvez les bandes caractéristiques de cette molécule.
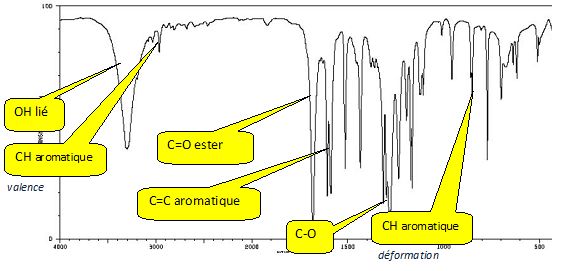
Pourquoi la bande à environ 3400 cm-1 est-elle large ?
Groupe O-H ( phénol) associassions par liaison hydrogène.
Le spectre RMN 1H du para-hydroxybenzoate de méthyle est représenté ci-dessous, l’intégration est précisée en dessous de chaque signal.
Attribuez les différents signaux, en précisant pour chacun d’eux le déplacement chimique, la multiplicité et l’intégration.
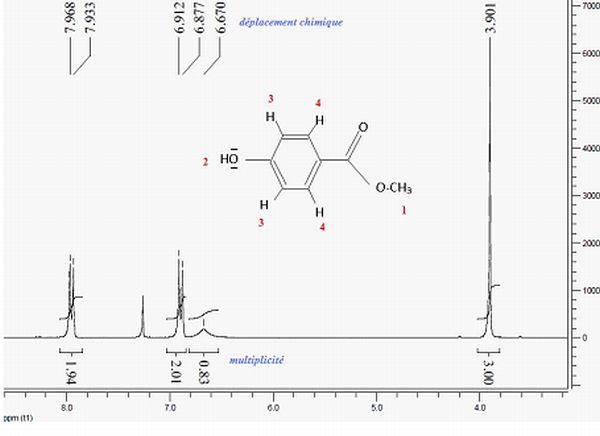
1 : trois protons, d = 3,9 ppm, aucun proche voisin, donc singulet.
2 : 1 proton, d = 6,67 ppm, aucun proche voisin, donc singulet.
3 : deux protons, d = 6,9 ppm, un proche voisin, donc doublet.
4 : deux protons, d = 7,9 ppm, un proche voisin, donc doublet.
|
On
réalise une analyse par spectrométrie de masse (impact électronique) du
parahydroxybenzoate de méthyle. Le spectre obtenu est représenté
ci-dessous.
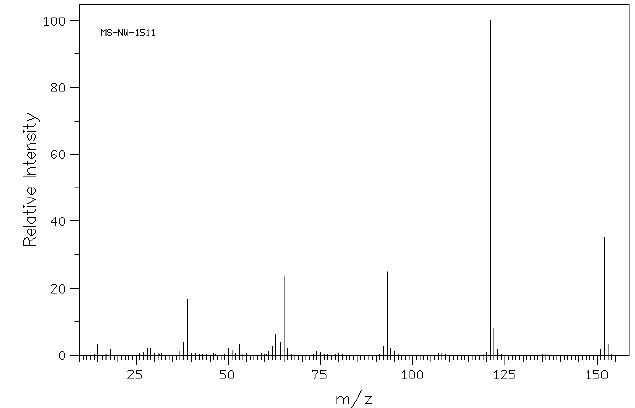
Que signifie le rapport m/z ? Rapport masse sur charge.
Quel est le pic moléculaire ? Pic à m/z =152.
Quel est le pic le plus abondant ? Proposez une structure pour ce fragment.
Pic à m/z = 121.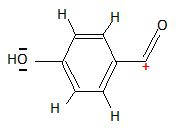
|
|





