Le sujet de ce
concours n'est pas
accessible depuis ce site.
Question 61.
Electrolyse d'une solution de sulfate de zinc.
Réduction des ions zinc à la cathode négative : Zn2+aq + 2e- = Zn(s). A est faux, B est vrai.
Le zinc métal se dépose sur la cathode négative. C est faux, D est vrai.
L'électrolyse est une transformation forcée. E est faux.
Réponses B, D.
Question 62.
(CH3)3N + H2O =(CH3)3NH+aq +HO-aq.
pH d'une solution de base forte de concentration c : pH = 14 + log c = 14 +log 10-2 = 12.
Le pH mesuré étant égal à 11, la raction de la triméthylamine avec l'eau est limitée. A, E sont faux. D est vrai.
xmax = cV ; xfin = n(HO-) ; [HO-aq] = 10-14 / 10-pH ; taux d'avancement final : xfin / xmax =n(HO-) / c = 10-14+pH / c =10-3 */ 0,01 = 0,10. B est vrai.
Réponses B, D.
|
|
Question 63.
Le dioxyde de soufre SO2 est un gaz qui a des
propriétés réductrices et qui est
présent dans l'air pollué. Quand on fait
barboter un grand volume d'air dans un litre d'eau, le
dioxyde de soufre va se dissoudre dans l'eau. Il est
possible par la suite, de le titrer à l'aide d'une
solution de permanganate de potassium, lors d'une
réaction 'oxydo-réduction.
Une solution S est préparée en faisant
barboter 1,00 104 m3 d'air
pollué dans V0 = 1,00 L d'eau. Un volume
V1 = 10,0 mL de cette solution est placé
dans un bécher de 100 mL. La solution violette de
permanganate de potassium de concentration c = 1,00
10-2 mol/L est ensuite versée goutte
à goutte jusqu'à persistance de la
coloration.
2MnO4-aq
+5 SO2
aq + 2H2O(l) = 2Mn2+
aq +5 SO42-aq
+4H+ aq.Tableau d'avancement :
|
avancement (mol)
|
2MnO4-aq
|
+5
SO2 aq
|
+ 2H2O(l)
|
= 2Mn2+ aq
|
+5
SO42-aq
|
+4H+ aq
|
|
initial
|
0
|
n2
|
n1
|
solvant
|
0
|
0
|
0
|
|
en cours
|
x
|
n2-2x
|
n1-5x
|
en
|
2x
|
5x
|
4x
|
|
xmax
|
n2-2xmax
|
n1-5xmax
|
large excès
|
2xmax
|
5xmax
|
4xmax
|
Quantité de matière de dioxyde de soufre
dans la prise : n1 = c1V1 ;
Quantité de matière d'ion permanganate
à l'équivalence : n2 =
cVéq ;
n1 = 2,5 n2 ;
c1V1 =2,5 cVéq ;
c1= 2,5 c Véq /
V1 = 2,5 * 1,00 10-2*8,0 / 10,0 =
2,0 10-2
mol/L. Réponses D.
Question 64.
Protection du fer par une électrode sacrificielle en zinc de masse m = 4,0 kg.
Zn(s) = Zn2+aq + 2e-.
Quantité de matière de zinc : n(Zn) =m / M(Zn) ~4000 / 60=200/3 mol.
Quantité de matière d'électron : n(e-) =2 n(Zn) = 400/3 mol.
Quantité d'électricité Q = n(e-) F ~400/3 *1,0 105 ~4,0 107 / 3 C.
Durée de la protection : Q / I = 4,0 107 / ( 3*4,0 10-2) = 109environ 10 ans.
Réponse B.
|
Question 65.
Formule brute : C3H6O2.
Tests positifs à la DNPH et à la liqueur de Fehling : c'est un aldehyde. A est vrai. B est faux.
Les atomes d'oxygène sont liés à un seul atome de carbone : pas d'éther mais une fonction alcool. C est vrai.
La chaine carbonée est saturée : C est faux. E est vrai.
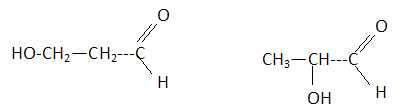
Réponses A, C, E.
Question 66.
Ag+ aq + Cl-
aq ---> AgCl solide.
Les conductivités molaires ioniques, li,
en S m2 mol-1, multipliées
par 103, de quelques ions sont reportés
ci-dessous :
|
cation
|
103 l
|
anion
|
103 l
|
|
H3O+
|
34,98
|
HO-
|
19,92
|
|
Na+
|
5,01
|
Cl-
|
7,63
|
|
Ag+
|
6,20
|
NO3-
|
7,14
|
On fait l'hypothèse que le volume de la solution est à peu près constant.
Avant l'équivalence : l'ion argent est en défaut ;
l'ion chlorure est en excès ; les ions nitrate et
sodium sont spectateurs. ( les ions oxonium et hydroxyde
sont minoritaires).
s = lNa+[Na+]
+ lCl-[Cl-]
+ lNO3-[NO3-].
lNa+[Na+] est constant ; [Cl-] diminue ; [NO3-] augmente. Du point de vue de la conductimètrie, tout revient à remplacer Cl- par NO3-, dont les conductivités molaires ioniques sont voisines.
La conductivité varie très peu ( légère diminution ). Après l'équivalence : l'ion chlorure est en défaut
; l'ion argent est en excès ; les ions nitrate et
sodium sont spectateurs. ( les ions oxonium et hydroxyde
sont minoritaires).
s = lNa+[Na+]
+ lAg+[Ag+]
+ lNO3-[NO3-].
On ajoute des ions Ag+ et NO3- : la conductivité croît.
Réponses C.
Question 67.
Synthèse de l'ammoniac : 2N2(g) + 3H2(g) = 2NH3(g).
La température est un facteur cinétique. A est vrai. B est faux.
La constante d'équilibre dépend de la température. C est vrai. D est faux.
La
concentration d'un réactif est un facteur cinétique ; la
concentration de ce dernier diminue au cours du temps, la vitesse
diminue donc. E est faux.
Réponses A, C.
Question 68.
Dismutation de l'eau oxygénée.
H2O2 (l) = H2O(l) + ½O2(g).
La catalyse par les ions Fe3+aq est homogène. La catalyse par un fil de platine est hétérogène. A, B sont vrais.
Un catalyseur accélère une réaction, le temps de demi-réaction est plus petit. C, E sont vrais.
Réponses A, B, C, E.
Question 69.
. 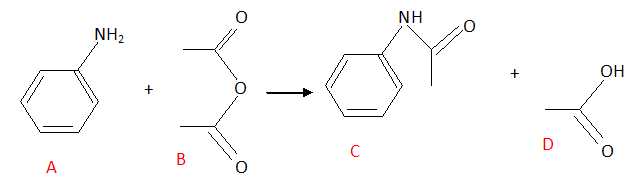
D : acide éthanoïque ou acétique. A est vrai.
A : aniline ; B : anhydride éthanoïque. B est faux.
C est un amide. C est faux.
La
réaction étant totale, une mole d'aniline A réagissant avec un
excès de B peut donner une mole de C et une mole de D. D est vrai. E est faux.
Réponses A, D.
Question 70.
Solution tampon réalisée à partir du couple CH3-COOH / CH3-COO-.
A la demi-équivalence du titrage de CH3-COOH par la soude, [CH3-COOH] =[CH3-COO-]. A est vrai. B est faux.
Le pH de la solution est égal au pKa du couple CH3-COOH / CH3-COO-, c'est à dire 4,8. C est vrai. D et E sont faux.
Réponses A, C.
|
|
|

