|
|
Sur l'étiquette du produit destiné à diminuer le pH de l'eau d'un aquarium, on peut lire que la solution commerciale S0 est constituée d'acide chlorhydrique ( H3O+aq + Cl-aq) mais aucune concentration n'est indiquée.
La concentration c0 de la solution commerciale est égale à la concentration en ion H3O+aq. On cherche à déterminer cette concentration par titrage pH-métrique.
Pour cela on dilue 50 fois la solution commerciale et on procède au titrage d'un volume VA = 20,0 mL de la solution diluée SA à l'aide d'une solution d'hydroxyde de sodium ( Na+aq + HO-aq ) SB de concentration molaire en soluté apporté cB = 4,0 10-2 mol/L.
On
obtient la courbe ci-dessous. On a également fait apparaître la coure
représentant la dérivée du pH en fonction du volume de soude versé ( en
pointillé ). 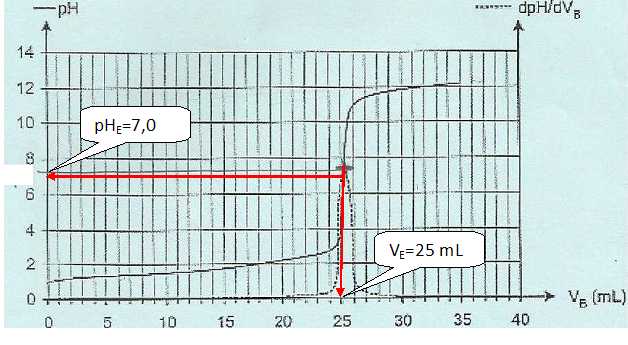
Ecrire l'équation de la réaction support du titrage.
H3O+aq +HO-aq =2H2O(l).
Définir l'équivalence.
A
l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiomètriques. Avant l'équivalence, l'un des réactifs
est en excès, après l'équivalence, l'autre réactif est en
excès.
En déduire la concentration en ion oxonium dans la solution SA.
cA VA = cB VE ; cA = cB VE /VA = 4,0 10-2 *25/20 = 5,0 10-2 mol/L.
Montrer que dans la solution commerciale, la concentration en ion oxonium est voisine de 2,5 mol/L.
Tenir compte de la dilution : 5,0 10-2 *50 =2,5 mol/L.
|
