|
|
On donne la formule semi-développée plane de la thyrosine.
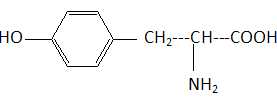
Combien de stéréoisomères la thyrosine possède-t-elle ? Indiquer la relation de stéréoisomérie existant entre les différents isomères.
La présence d'un atome de carbone asymétrique conduit à deux stéréoisomères ( énantiomères ).
Faire la représentation de Fischer de la L-thyrosine.
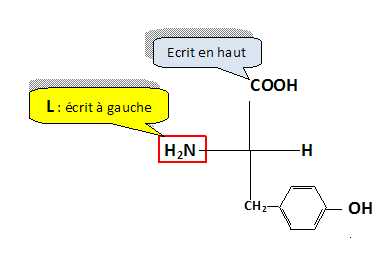
La
première étape de la synthèse consiste à faire réagir la L-thyrosine
avec un mélange sulfonitrique à 0°C puis à ttraiter le milieu
réactionnel par de la soude jusqu'à un pH neutre. Après purification,
on obtient un solide A. Lors de cette réaction, l'entité réactive est
l'ion nitronium NO2+.
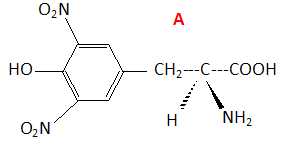
Préciser la nature de cette réaction.
Substitution électrophile sur le noyau benzénique.
La seconde étape consiste à faireréagir l'anhydride acétique sur A. Après divers traitements, on obtient le composé B.
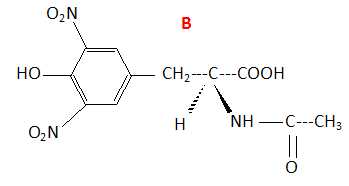
Indiquer le nom de la nouvelle fonction créée. Donner le nom de la liaison C-N formée.
Fonction amide ; liaison peptidique.
|
| .
. |
.
|
Lors
de la troisième étape on réalise l'estérification de B avec l'éthanol
absolu, en présence d'acide fort. Après extraction et purification, on
obtient le composé C.
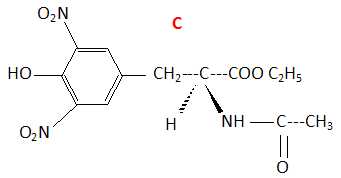
Ecrire l'équation de la réaction en écrivant B sous la forme R-COOH.
R-COOH + C2H5OH = R-COOC2H5 + H2O.
Indiquer les propriétés d'une réaction d'estérification.
Lente, pratiquement athermique, limitée par l'hydrolyse de l'ester.
Pourquoi l'éthanol est-il introduit en gros excès ?
L'excès d'éthanol déplace l'équilibre dans le sens direct, formation de l'ester.
Pourquoi est-il indispensable d'utiliser de l'étanol absolu ?
Il faut éviter l'hydrolyse de l'amide.
|
Après six autres étapes on obtient la L-thyroxyne représentée ci-dessous.
Montrer que l'unique atome de carbone asymétrique est de configuration S.
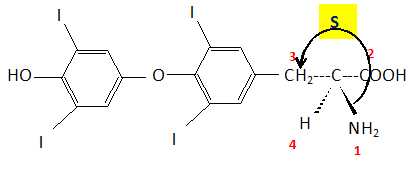 . . |
|