|
|
On prépare une solution aqueuse S1 en dissolvant 0,10 mol de nitrate d'argent AgNO3(s) et 0,30 mol de cyanure de potassium KSCN(s) par litre de solution.
Faire l'inventaire des espèces chimiques dissoutes en solution. Donner la formule et le nom de chacune.
Ion argent Ag+aq ; ion nitrate NO3-aq ; ion potassium K+aq ; ion cyanure SCN-aq.
Le numéro atomique du potassium est Z=19.
Donner la structure électronique de l'ion potassium. Justifier que cet ion est plus stable que l'atome de potassium.
1s2 2s2 2p6 3s2 3p6, couche externe saturée à 8 électrons.
Dans la solution S1, il se forme le complexe dicyanatoargentate (I) Ag(SCN)2-.
Ecrire l'équation de sa formation.
Ag+aq + 2 SCN-aq = Ag(SCN)2-aq. (1)
Ecrire l'expression littérale de la constante de formation du complexe.
Kf = [Ag(SCN)2-aq] / ([Ag+aq][SCN-aq]2.
On plonge dans la solution S1 une électrode d'argent dont on mesure le potentiel E1 = 0,40 V par rapport à l'électrode normale à hydrogène. E°(Ag+aq / Ag(s)) = 0,80 V.
Ecrire l'équation de la demi-équation de la réaction se produisant à l'électrode d'argent.
[Ag+aq] +e- = Ag(s).
Montrer par le calcul que la concentration en ion argent restés libres après formation du complexe est négligeable.
E1 = E°(Ag+aq / Ag(s)) + 0,059 log [Ag+aq]
log [Ag+aq] =( E1 - E°(Ag+aq / Ag(s)) ) / 0,059 = (0,40-0,80) / 0,059 = -6,78 ; [Ag+aq] =1,66 10-7 ~1,7 10-7 mol/L.
Conclure quand à la stabilité de ce complexe.
Pratiquement
tous les ions argent (I) initiaux ont réagi avec les ions cyanure
introduits en excès. L'équilibre (1) est donc déplacé dans le sens
direct, formation du complexe. Ce dernier est donc très stable.
Etablir le tableau d'avancement de la réaction de formation du complexe. ( on prendra 1 L de solution ).
| avancement (mol ) | Ag+aq | + 2 SCN-aq | = Ag(SCN)2-aq | | initial | 0 | 0,10 | 0,30 | 0 | | en cours | x | 0,10-x | 0,30-2x | x | | à l'équilibre | X = xéq~0,10 | 0,10-X = 1,66 10-7 | 0,30-2X~0,10 | X~0,10 |
En déduire la constante de formation Kf.
Kf = [Ag(SCN)2-aq] / ([Ag+aq][SCN-aq]2 = 0,10 / (1,66 10-7* 0,102) =6,0 107.
Kf est très grande, le complexe est très stable.
|
| .
. |
.
.
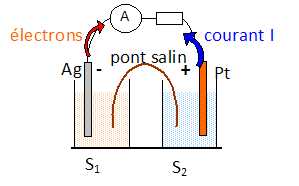
On forme une pile en associant les deux demi-piles suivantes :
Demi-pile 1 : électrode d'argent plongeant dans la solution S1.
Demi-pile 2 : électrode de platine plongeant dans une solution S2 obtenue en dissolvant par litre 5,0 10-3 mol de sulfate de chrome (III) Cr2(SO4)3, 2,0 10-2 mol de dichromate de potassium K2Cr2O7 et de l'acide sulfurique pour que le pH soit égal à 2.
Faire le schéma de cette pile débitant dans une résistance.
Pour la demi-pile 2, on considère le couple Cr2O72-aq / Cr3+aq. E° = 1,36 V.
Ecrire l'équation de la réaction se produisant à l'électrode de platine.
Cr2O72-aq + 6e- + 14H+aq = 2 Cr3+aq + 7H2O.
Donner l'expression littérale du potentiel d'électrode E2 de la demi-pile 2.
E2 = E°(Cr2O72-aq / Cr3+aq ) + 0,059/6 log([Cr2O72-aq][H+aq]14/ [Cr3+aq]2).
E2 = 1,10 V.
Indiquer les polarités de la pile ainsi que le sens du courant quand elle débite. ( voir schéma ).
Calculer la force électromotrice de la pile
E = E2-E1 = 1,10-0,40 = 0,70 V..
|
.
|
