Traitements mis
en oeuvre lors d'une intoxication au monoxyde de carbone, Capes 2014.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Le
monoxyde de carbone est un gaz incolore, inodore, non irritant, très
toxique du fait de sa liaison avec l'hémoglobine qui entrave la
libération d'oxygène au niveau tissulaire.
L'objectif de cette partie est l'étude du traitement d'une intoxication
au monoxyde de carbone : la formation du monoxyde de carbone est
abordée dans un premier temps, puis les principes du transport du
dioxygène dans le sang sont analysés et le principe du traitement d'une
intoxication est enfin étudié.
Formation du monoxyde de carbone.
Ecrire l'équation de la combustion complète d'un hydrocarbure de formule brute CxHy dans le dioxygène.
CxHy (g) + (x +0,25 y )O2 (g) ---> x CO2 (g)+½y H2O (l).
Déterminer
l'enthalpie de cette réaction de combustion à 298 K, suposée
indépendante de la température, lorsque l'hydrocarbure est du
méthane et que l'eau est à l'état liquide. Le méthane est le principal constituant du gaz naturel.
DfH° ( CO2, g) = -393,5 kJ mol-1 ; DfH° ( H2O, l) = -285,8 kJ mol-1 ; DfH° ( CH4, g) = -74,4 kJ mol-1.
CH4 (g) + 2 O2 (g) ---> CO2 (g)+2 H2O (l).
DrH° = DfH° ( CO2, g)-2DfH° ( H2O, l) -DfH° ( CH4, g) -2 DfH° ( O2, g).
DrH° = -393,5 + 2*(-285,8) - (-74,4) = -890,7 kJ mol-1.
Le
pouvoir calorifique supérieur ( PCS) d'un combustible gazeux est
l'énergie échangée par transfert thermique lors d'une combustion
complète d'un mètre cube de gaz ( assimilé à un gaz parfait et pris à
une pression de 1,00 bar et une température de 298 K ) lorsque l'eau formée est liquide et que la combustion est réalisée à pression constante.
Déterminer le PCS du méthane.
Volume molaire Vm = 8,314*298 / (1,00 105) =0,024776 m3 mol-1.
Quantité de matière de méthane dans 1 m3 : n = 1 / 0,024776 =40,36 mol.
PCS = 890,7 *40,36 =3,595 104 ~3,60 104 kJ m-3.
Un brûleur à gaz naturel fournit une puissance thermique P = 800 kW.
Déterminer les débits volumique qv du méthane et q'v d'air ( pris à 298 K sous 1 bar ) pour obtenir cette puissance.
qv = P / PCS = 800/(3,595 104)=2,225 10-2 m3 s-1.
Débit volumique du dioxygène = 2 qv = 4,45 10-2 m3 s-1.
L'air contient 20 % de dioxygène en volume : q'v = 5*4,45 10-2 =0,226 m3 s-1.
Que signifie l'expression "combustion incomplète".
Par défaut de dioxygène, il se forme non seulement du dioxyde de
carbone, mais également du monoxyde de carbone et du carbone lors de la
combustion du méthane.
Dans les véhicules à essence, la combustion incomplète du carburant produit du monoxyde de carbone.
De quel dispositif les véhicules sont-ils équipés pour réduire la quantité de monoxyde de carbone dans l'atmosphère ? En expliquer le principe en quelques lignes en utilisant un vocabulaire adapté à des élèves de terminale S.
Le pot catalytique : la structure interne du pot est conçue pour offrir
une grande surface de contact entre les catalyseurs ( platine, oxyde de
cérium ) et les gaz d'échappement. Ces catalyseurs déclenchent ou
accentuent les réactions chimiques qui transforment les gaz les plus
toxiques ( CO, hydrocarbures imbrûlés, oxydes d'azote ) en éléments
moins toxiques ( eau et CO2). Ce pot est efficace à partir de 400°C ( donc relativement inefficace en ville et sur les petits trajets ).
|
|
|
Transport et stockage du dioxygène dans le corps.
Le
dioxygène est faiblement soluble dans le sang. Le stockage et le
transport du dioxygène dans le corps sont assurés par deux protéines,
la myoglobine ( notée Mb) et l'hémoglobine ( notée Hb).
Qu'est-ce qu'une protéine ?
Une protéine est une macromolécule biologique composée d'acides aminés liés entre eux par des liaisons peptidiques.
La myoglobine.
La myoblobine est fixée à un groupe hème, groupe au sein duquel l'ion fer II est complexé par le ligand protoporphyrine IX.
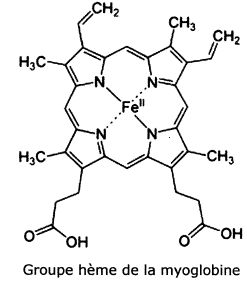
Donner
la configuration électronique de l'ion fer II dans son état
fondamental. Quels sont les électrons impliqués dans la formation des
liaisons avec les ligands ?
Configuration électronique de l’atome de fer ( Z=26) dans son état
fondamental : 1s2 2s2 2p6 3s2
3p6 3d6 4s2.
Configuration électronique de l’ion Fe2+ 1s2
2s2 2p6 3s2 3p6 3d6
( perte facile des 2 électrons 4s2).
Les électrons des orbitales 3d sont impliqués dans la formation des liaisons avec les ligands.
Justifier par un argument structural qu'une solution de protoporphyrine ( dénuée de fer) soit colorée.
L'existence d'une séquence longue de doubles liaisons conjuguées dans
une molécule organique créé un nuage électronique délocalisé. Cette
séquence est responsable de la couleur de la solution.
Le dioxygène peut se fixer à l'ion fer II de la myoglobine selon
l'équation de réaction suivante, de constante d'équilibre K : Mb aq + O2(g) = MbO2 aq.
Considérons la mise en contact d'une solution de myoglobine de concentration molaire initiale [Mb]0 avec une phase gazeuse dans laquelle la pression partielle en dioxygène, notée p(O2), est maintenue constante.
Les biochimistes définissent la saturation fractionnelle de la myoglobine, notée sMb,
comme le rapport de la quantité de dioxygène fixé à l'équilibre à la
myoglobine sur la quantité maximale de dioxygène qui pourrait être fixé
:
sMb = [MbO2] / [Mb]0 où MbO2 est la concentration molaire de MbO2 en solution à l'équilibre.
Exprimer la saturation fractionnelle de la myoglobine en fonction de p(O2), de la pression standard p° et de K.
K = [MbO2] / (p(O2) / p° [Mb]) avc [Mb] = [Mb]0 -[MbO2].
K p(O2) [Mb]0 -K p(O2)[MbO2]=[MbO2]p°.
[MbO2](p°+Kp(O2)) = K p(O2) [Mb]0 ;
sMb =[MbO2] / [Mb]0 = K p(O2) / (p°+Kp(O2)).
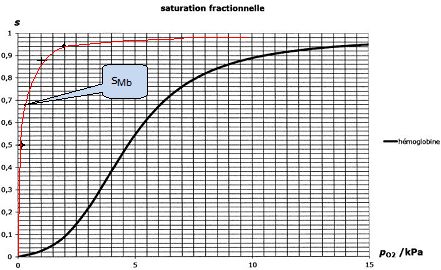
Pour p(O2) = 0,13 kPa, la moitié des molécules de myoglobine est oxygénée, c'est à dire convertie en MbO2.
En déduire la valeur de K.
sMb =0,5 ; p° = 1 bar ; p(O2) = 1,3 10-3 bar.
0,5 = 1,3 10-3 K / (1+1,3 10-3 K) ; 0,5 +6,5 10-4 K = 1,3 10-3 K ; K = 0,5 / (6,5 10-4)= 7,7 102.
Tracer l'allure de l'évolution de sMb en fonction de p(O2) sur le graphe suivant en le superposant à la courbe déja tracée.
|
.
|
|
L'hémoglobine.
En
première approximation, l'hémoglobine Hb peut être considérée comme un
tétramère de myoglobine. Elle possède donc 4 groupes hème et peut fixer
4 molécules de dioxygène selon les 4 réactions d'équations :
(1) Hb aq + O2(g) = HbO2 aq constante K1 = 7,5.
(2) HbO2 aq + O2(g) = Hb(O2)2 aq constante K2 = 15.
(3) Hb(O2)2 aq + O2(g) = Hb(O2)3 aq constante K3 = 30.
(4) Hb(O2)3 aq + O2(g) = Hb(O2)4 aq constante K4 = 60.
Pourquoi peut-on dire, au vu des valeurs des Ki, que la fixation de dioxygène est un exemple de "fixation coopérative" ?
Les constantes ont des valeurs croissantes.
La
fixation de la première molécule de dioxygène induit un changement de
la conformation spatiale de l'hémoglobine. Cela augmente l'affinité du
site de liaison de la seconde molécule de dioxygène. La fixation de la
seconde augmente l'affinité de liaison de la troisième et ainsi de
suite.
Considérons la mise en contact d'une solution d'hémoglobine de concentration molaire initiale [Hb]0 avec une phase aqueuse dans laquelle la pression partielle en dioxygène, notée p(O2) est maintenue constante. Le graphe ci-dessus représente la satiration fractionnelle de l'hémoglobine sHb, définie de la même façon que sMb, en fonction de la pression en dioxygène. Les biochimistes appellent ps0 la pression partielle en dioxygène pour laquelle la saturation fractionnelle s est de 50 %.
Donner les valeurs de ps0 pour la myoglobine et pour l'hémoglobine.
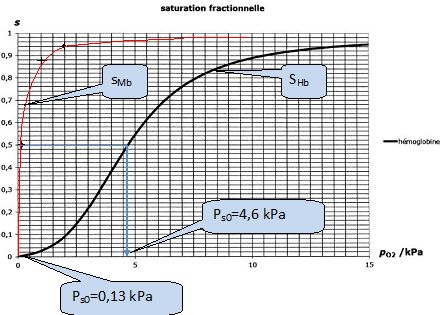
Dans les poumons la pressions partielle en dioxygène est voisine de 12 kPa, dans les tissus elle vaut environ 4 kPa.
Justifier graphiquement les affirmations suivantes :
" l'hémoglobine emmagasine le dioxygène au niveau des poumons et le libère dans les tissus "
" L'hémoglobine constitue une réserve de dioxygène".
SHb ~0,95 dans les poumons ; SHb ~0,4 dans les tissus.
La saturation fractionnelle de l'hémoglobine est maximale, voisine de 1 dans les poumons.
|
Toxicité du monoxyde de carbone et traitement des intoxications au monoxyde de carbone.
Le
monoxyde de carbone peut se lier à l'ion fer II de l'hème de
l'hémoglobine et prendre la place du dioxygène pour former la
carboxyhémoglobine HbCO, ce que l'on peut modéliser par la réaction
d'équation (5) :
Hb(O2) aq + CO (g) = HbCO aq + O2(g).
Justifier que le monoxyde de carbone puisse se lier à l'ion fer II de l'hémoglobine.
L'interaction
métal / ligand est du type acide de Lewis / base de Lewis. Le monoxyde
de carbone, molécule porteuse de doublets d'électrons libres est une
base de Lewis.
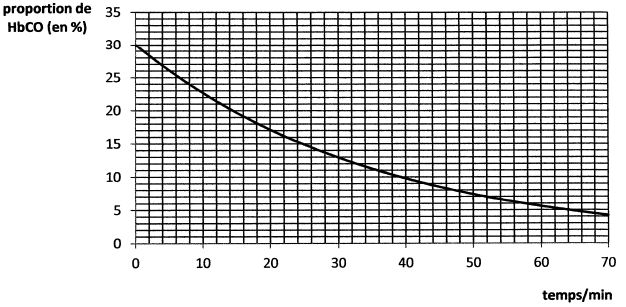
Pour traiter l'intoxication au monoxyde de carbone, on fait repirer au
patient intoxiqué de l'oxygène pur sous une pression supérieure à 1
bar. L'évolution de a concentration en carboxyhémoglobine, pour une
pression en dioxygène inspiré constante, a été suivie au cours du temps
afin d'étudier la cinétique de la réaction d'équation : HbCO aq + O2(g)=Hb(O2) aq + CO (g).
On suppose que sa loi de vitesse peut se mettre sous la forme v = k [HbCO)a p(O2)ß.
La courbe suivante montre le résultat obtenu pour une pression en dioxygène inspiré p(O2) = 2,0 bar.
L'expérience a été répétée pour différentes pressions en dioxygène. Le tableau suivant donne les temps de demi-réaction t½ obtenus pour différentes pressions p(O2) en dioxygène.
p(O2) bar
|
0,2
|
1,0
|
1,5
|
2,0
|
2,5
|
t½ ( min)
|
250
|
50
|
33
|
25
|
20
|
Donner la définition du temps de demi-réaction.
Le temps de demi-réaction est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
Exploiter les résultats expérimentaux pour déterminer a et ß.
Le
temps de demi-réaction est inversement proportionnel à la pression en
dioxygène. L'ordre partiel par rapport au dioxygène est ß = 2.
A partir du grapghe ci-dessus ( p(O2) = constante ).
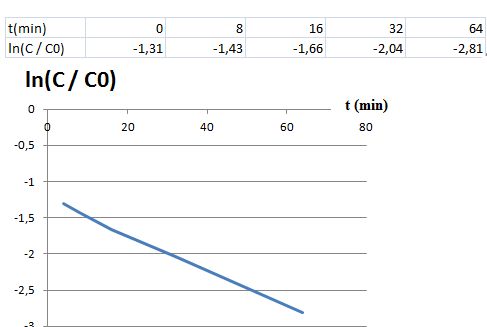
L'hypothèse d'un ordre partiel a = 1 pour HbCO est vérifiée.
|
|