|
|
|
|
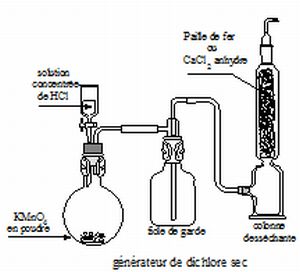
Préparation du
dichlore.
Une technique consiste à faire réagir de l'acide chlorhydrique
concentré sur des cristaux de permanganate de potassium. Le gaz obtenu
traverse ensuite deux flacons laveur, l'un contenant de l'eau et
l'autre une solution d'acide sulfurique concentré. Le dichlore est
ensuite récupéré dans un flacon à gaz.
Faire un schéma du
montage utilisé en précisant le matériel utilisé.
Ecrire
l'équation de la réaction de formation du dichlore.
Oxydation de l'ion chlorure : 5 fois {2Cl- aq= Cl2(g)
+ 2e-}.
Réduction de l'ion permanganate : 2 fois {MnO4-
aq+ 8H+ aq+ 5e- = Mn2+aq + 4H2O(l)
}.
2MnO4-
aq+ 16H+ aq + 10e- +10Cl- aq= 2Mn2+
aq+ 8H2O(l) +5Cl2(g)
+ 10e-.
Simplifier : 2MnO4-
aq+ 16H+ aq +10Cl- aq= 2Mn2+
aq+ 8H2O(l) +5Cl2(g).
Justifier
l'utilisation de deux flacons laveurs.
Pour éliminer les traces de chlorure d'hydrogène faire barboter le gaz
dans un flacon laveur contenant une solution saturée de chlorure de
sosium. Le dichlore contient des traces d'eau.
Faire passer le gaz dans une colonne désséchante contenant de la paille
de fer. En présence d'eau le dichlore oxyde le fer en chlorure de fer
(III). Ce dernier cristallise avec 6 molécules d'eau.
Ou bien utiliser un flacon laveur contenant de l'acide sulfurique
concentré. Ce dernier élimine l'eau.
En cours de réaction, le récipient contenant le permanganate contient
aussi un résidu brun. Justifier cet
observation.
Il se forme également du dioxyde de manganèse MnO2.
Préciser les
consignes de sécurité à respecter lors de cette manipulqtion.
Acide chlorhydrique : liquide et vapeur
corrosifs. L'ion permanganate est dangereux pour l'environnement. Le
dichlore est un gaz toxique.
Port de blouse, gants et lunette de protection ; travailler sou hotte
aspirante.
Placer les résidus dans le bidon de récupération des métaux lourds.
Comment peut-on
détruire le dichlore non utilisé ?
Le
dichlore est soluble dans une solution de soude : dismutation en ClO-
et Cl- ( eau de Javel). Une solution concentrée de
thiosulfate de sodium va réduire le dichlore résiduel.
Donner
deux autres méthodes de préparation du dichlore.
Action de l'acide
chlorhydrique sur l'eau de Javel.
Electrolyse d'une solution aqueuse de chlorure de sodium.
|
.
|
Manipulation
de l'acétonitrile.
L'acétonitrile est un produit chimique inflammable. Il est nocif par
inhalation, contact avec la peau et ingestion. Il est irritant pour les
yeux.
Quels pictogrammes
s'attend-t-on à trouver sur le flacon ?
Comment
réagissez-vous en cas :
-
d'inhalation : faire repirer de l'air frais.
- de contact avec la peau et les yeux : laver abondamment à grande eau.
Consulter un ophtalmologiste.
- d'ingestion : faire boire beaucoup d'eau. Consulter un médecin.
Quelles
sont les consignes de sécurité à respecter lors de la manipulation
d'acétonitrile ?
Tenir à l'écart de toute source d'ignition.
Protection respiratoire, protection des yeux, protection des mains (
gants polypropylène épaisseur 0,7 mm ); vétement de protection
ignifuges et anti-statiques.
Se laver les mains et le visage après le travail.
Le point d'éclair de l'acétonitrile est de 2°C.
Que
signifie cette valeur ?
Température la plus basse à laquelle un corps combustible émet
suffisamment de vapeurs pour former avec l'air ambiant, un mélange
gazeux qui s'enflamme sous l'effet d'une source de chaleur, mais pas
suffisamment pour que la combustion s'entretienne d'elle-même.
Diagramme
de phase MgO-NiO.
Les oxydes de magnésium et de nickel sont des matériaux réfractaires,
fondant respectivement à 2800 °C et 1960 °C.
Définir
les termes "réfractaires " et "miscibles".
Un matériau réfractaire offre une grande résistance à température
élevée.
La miscibilité indique
si deux liquides peuvent se mélanger pour former une solution homogène.
Construire
le diagramme binaire MgO-NiO à l'aide des données suivantes.
x est la fraction molaire de MgO dans la phase solide ou dans la phase
liquide et T la température de la phase.
x
|
0
|
0,1
|
0,2
|
0,3
|
0,4
|
0,5
|
0,6
|
0,7
|
0,8
|
0,9
|
1
|
T
solide
|
1960
|
2025
|
2090
|
2160
|
2230
|
2310
|
2400
|
2485
|
2575
|
2675
|
2800
|
T
liquide
|
1960
|
2100
|
2220
|
2325
|
2415
|
2500
|
2565
|
2630
|
2690
|
2745
|
2800
|
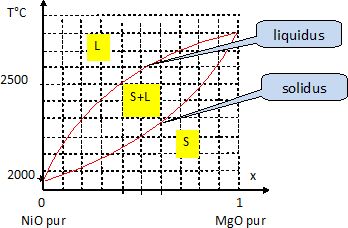
De
l'allure du diagramme obtenu, que peut-on en déduire de la miscibilité
des deux solides ?
Le diagramme possède un seul fuseau. Les deux espèces solides sont
totalement miscibles.
Si l'on accepte que ces deux solides ont un caractère ionique prononcé
et que les rayons ioniques sont respectivement 86 pm pour Mg2+
et 83 pm pour Ni2+,
le
résultat précédent est-il attendu ?
Ce résultat était atendu, les rayon ioniques des deux cations étant
très proche.
Comment
les valeurs du tableau peuvent-elles être obtenues expérimentalement
?
Pour détecter le début et la fin de la solidification, on utilise une
courbe d'analyse thermique : on fait un mélange liquide, on le fait
refroidir et l'on mesure l'évolution de sa température T en fonction du
temps. Les ruptures de pentes
de la courbe marquent le début de la solidification (liquidus) et la
fin de la solidification (solidus).
Identifier,
en les nommant, les deux branches de courbes du diagrame de phase et
préciser, sur le graphique, les domaines d'existence des phases solides
et liquides.
La courbe du haut correspond au liquidus, température au dessus de
laquelle il n'y a que du liquide ; la courbe du bas correspond au
solidus, température en dessous de laquelle il n'y a que du solide.
|
|
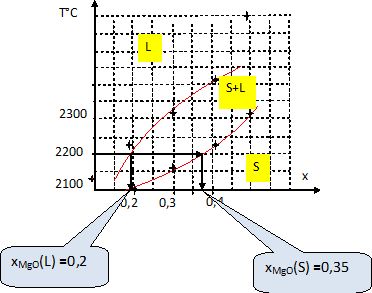
Quelle est la
température de fusion commençante d'un mélange d'oxydes solides de
composition x = 0,30 en MgO ?
Le tableau indique une température du solide T = 2160 °C.
On poursuit la chauffe du mélange précédent jusqu'à 2200 °C.
Déterminer
la composition des phases en présence et leur proportions relatives.
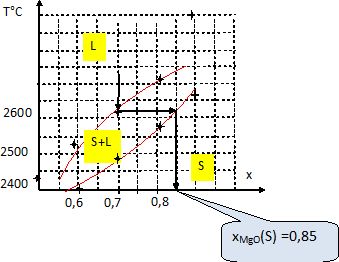
On refroidit un liquide de
composition x = 0,7 en MgO.
A
quelle température commence la solidification et quelle est la
composition des premiers cristaux formés ?
Le tableau indique pour x = 0,7 : la solidification débute à 2630 °C et
se termine à 2485°C.
L'oxyde MgO présente une structure cristalline type NaCl.
Schématiser
la maille cristalline en identifiant les sites occupés par l'anion oxo O2-. En déduire la
coordinence de chaque ion.
Structure cubique à faces centrées.
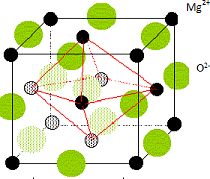
Coordinence ou nombre
de plus proches voisins de signe contraire = 6:
Chaque ions se trouve au centre d'un octaèdre dont les sommets sont
occupés par des ions de signe contraire.
On suppose que le rayon
ionique de l'anion oxo est voisin de 121 pm.
En
déduire une estimation du paramètre de la maille de l'oxyde MgO.
a = 2(RMg2+ + RO2- )=2(86+121)=414
pm.
|
|





