|
|
|
|
La
séparation des métaux par électrolyse, à partir de leurs ions en
solution, est possible avec de bons rendements. Dans de nombreux cas
l'enregistrement préalable de courbes intensité-potentiel dans des
conditions stationnaires est souhaitable. On dispose au laboratoire des
appareils suivants :
- boîtes de résistance, voltmètre à forte impédance, milliampèremètre, potentiostat, cellule conductimétriques.
- diverses électrodes conductrices ( de platine, de carbone vitreux, d'or ).
- électrode au calomel saturé en KCl, électrode de chlorure d'argent, électrode de verre.
- petites cellules en verre pirex.
Sur le schéma ci-dessous, identifier les différents éléments permettant d'enregistrer une courbe intensité-potentiel.
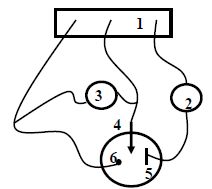
(1)
: potentiostat ; (2) milliampèremètre en série ; (3) voltmètre en
parallèle ; (4) électrode de travail ; (5) électrode auxiliaire en
platine ; (6) électrode de référence.
On a enregistré, à l'aide du montage ci-dessus, la courbe de
polarisation d'une électrode de platine plongeant dans une solution
aqueuse de nitrate de sodium à 0,1 mol/L.
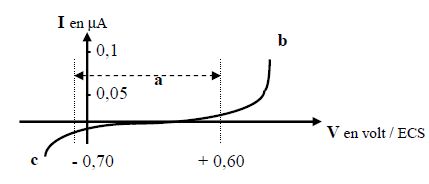
Identifier les parties de la courbe qui correspondent à des échanges électrochimiques avec l'électrode.
Les
parties de la courbe qui ne sont pas confondues avec l'axe horizontal
corespondent à des échanges d'électrons avec les électrodes.
Identifier les réactions électrochimiques en cause.
La
partie de la courbe sous l'axe horizontal correspond à une réduction ;
la partie située au dessus de l'axe horizontal correspond à une
oxydation.
On peut enregistrer une courbe de polarisation, dans un montage
électrochimique à trois électrodes, à l'aide d'une électrode solide
tournante. La figure ci-dessous représente la courbe obtenue avec un
disque de platine poli tournant à 2000 tours par minute, pour une
solution constituée d'un mélange équimolaire de bromure de sodium et de
dibrome de concentration 5 10-3 mol/L dans l'acide sulfurique 1 mol/L. La vitesse de balayage des potentiels est de 2 mV/s.
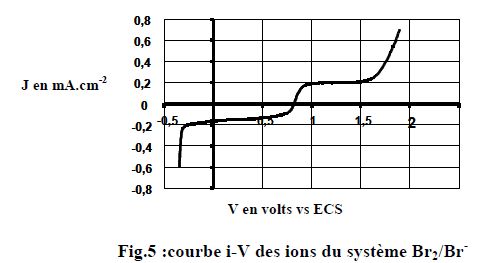
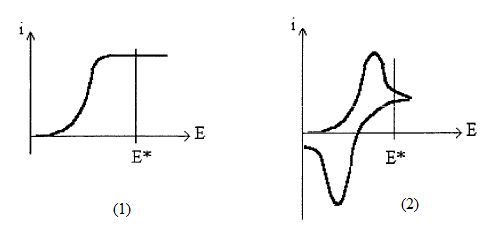
Mise à part les branches correspondant aux parties b et c le courant
observé présente l'allure d'une courbe en "S", couramment désignée sous
le vocable de "vague polarographique".
Identifier les réactions électrochimiques qui correspondent à cette vague polarographique.
Partie inférieure, réduction du dibrome : Br2 +2e- = 2 Br-.
Partie supérieure, oxydation de l'ion bromure : 2 Br- + 2e- = Br2.
Identifier le phénomène responsable de la quasi-onstance du courant entre 1 V et 1,5 V ( i1 ~0,2 mA) et entre 0 et -0,5 V( i2 ~ -0,2 mA).
La concentration des espèces qui réagissent aux électrodes diminue au
voisnage des électrodes. Un apport de matière est nécessaire depuis le
sein de la solution. Ce phénomène de diffusion limite l'intensité du
courant et on observe des paliers sur la courbe.
Entre ces deux domaines le courant varie rapidement. On appelle potentiel de demi-vague E½ la valeur du potentiel qui correspond à une valeur du courant demi-somme des deux courants précédents ( j1+j2) / 2.
Evaluer E½ dans cette expérience .
( j1+j2) / 2 = 0 et E½~0,8 V.
Déduire de l'allure de la courbe, si le système étudié correspond à des échanges électroniques rapide ou lent.
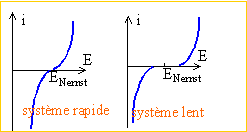
Les échanges électroniques peuvent être considérés comme rapides.
Pourquoi
place-t-on un flacon laveur contenant de la soude à la sortie du
montage ? Ecrire les réactions qui s'y produisent.
(1) avec rotation de l'électrode, la vitesse d'apport de matière est constant, indépendant du temps.
(2) sans convection, la vitesse d'apport de matière n'est pas constante.
|
.
|
Des courbes de polarisation peuvent également être enregistrées avec une électrode à goutte de mercure ( polarographie).
On a enregistré le polarogramme d'une solution 10-3 mol/L de nitrate de cadmium Cd(NO3)2 dans le nitrate de potassium 0,1 mol/L après 2 minutes de barbotage de diazote.
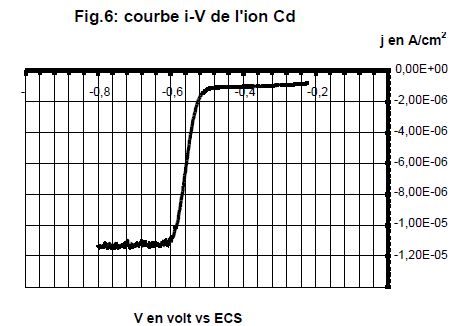
Indiquer l'importance du barbotage de diazote.
Avant chaque analyse,il faut éliminer l’oxygène dissous dans la solution. En effet, celui-ci présente deux vagues de réduction.
O2 + 2e- +2H+ =H2O2.
H2O2 + 2e- +2H+ =2H2O
Les vagues correspondantes se situant dans
l'intervalle potentiel[ -500 mV ; -1200 mV, rendent inutilisable
le polarogramme. Iil est donc nécessaire de
l’éliminer par barbotage d’azote dans la solution pendant quelques minutes.
Justifier l'utilisation d'une solution de KNO3.
Si
la solution n’est pas agitée, le transport des espèces électroactives
vers l’électrodes’effectue par migration et par diffusion.
On ajoute , le plus souvent, un large excès d’électrolyte indifférent également appelé électrolyte support. Dans ce cas :
– La migration des espèces redox devient négligeable et leur transport
dans la solution s’effectue par diffusion.On peut ainsi réduire sur la
cathode un cation, un anion ou bien une espèce neutre.
– La force ionique de la solution est imposée par l’électrolyte support
et les coefficients d’activité des espèces redox restent constants.
A quel processus électrolytique correspond la vague observée ?
Réduction de l'ion cadmium : Cd2+ + 2e- = Cd(s).
|
|
On a maintenant enregistré le polarogramme d'un mélange d'ions Cd2+ / Zn2+, dans les mêmes conditions expérimentales qu'à la question précédente.
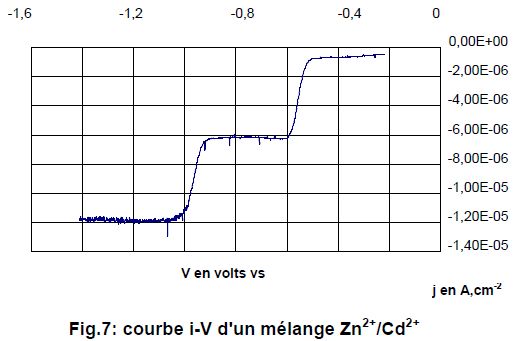
Identifier les processus électrochimiques correspondant aux deux paliers de courants observés.
Réduction de l'ion zinc ( palier compris entre -1,4 et -1 V) : Zn2+ + 2e- = Zn(s).
Réduction de l'ion cadmium pour l'autre palier ( palier compris entre -1 et -0,6 V) : Cd2+ + 2e- = Cd(s).
Estimer le potentiel de demi-vague du zinc dans ces conditions. E½ ~ -0,95 V.
On souhaite maintenant éliminer le cadmium présent dans un minerai de
zinc. La solution obtenue après traitement du mélange d'oxydes par de
l'acide sulfurique est électrolysée sur cathode d'aluminium pour
laquelle la surtension du dihydrogène est similaire à celle du mercure.
Définir le terme de surtension.
La surtension électrochimique ( à intensité donnée ), est la différence
entre la valeur expérimentale du potentiel à appliquer à l’électrode
pour obtenir cette intensité et celle du potentiel thermodynamique
d’oxydoréduction.
Quel potentiel contrôlé faut-il appliquer à la cathode pour ne déposer que le cadmium ? ~ -0,6 V.
Quel est le profil de la courbe j(t) pendant l'électrolyse et à quel moment peut-on considérer que l'électrolyse est terminée ?
j(t) étant proportionnelle à la concentration en ion cadmium, j(t)
diminue au cours de l'électrolyse. Celle-ci est terminée lorsque j(t)
s'annule.
On poursuit l'électrolyse avec une nouvelle cathode d'aluminium mais cette fois avec un montage à intensité imposée.
Quel est le métal récupéré à la cathode ?
L'eau et l'ion zinc peuvent être réduits à la cathode. On observe un
dépôt de zinc à la cathode du fait de la grande surtension du
dihydrogène.
L'ampèremètre indique I = 1,5 A et l'électrolyse dure 7 heures.
Quelle est la quantité de zinc récupéré ?
Q = I t = 1,5*7*3600 = 3,78 104 C.
Quantité de matière d'électron : n(e-) = Q / 96485 = 3,78 104 /96485 =0,3918 mol.
Le zinc étant bivalent n(Zn) = ½n(e-) =0,196 mol soit m = n(Zn) M(Zn) =0,196*65,4 = 12,8 g.
|
|






