|
|
|
|
Synthèse
de l'ibuprofène.
L'ibuprofène est un anti-inflammatoire et un analgésique développé dans
les années 1960. Masse molaire M = 206,3 g/mol ; Tfusion
= 76°C. Solide blanc soluble dans l'acétone, l'éthanol, le chloroforme,
l'éther.
Cette molécule peut être obtenue par la suite réactionnelle suivante :
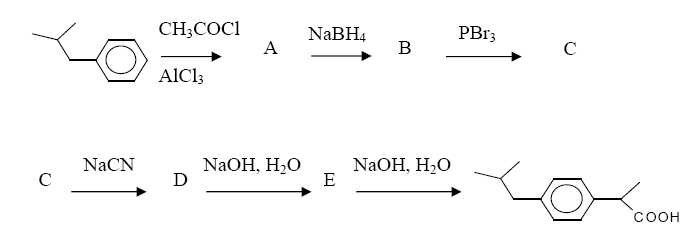
Comment
appelle-t-on la réaction qui permet d'obtenir A ?
Acylation de Friedel et Crafts.
Donner
la formule semi-développée et le mécanisme de formation de A en
trécisant le rôle et la nature chimique de AlCl3.
AlCl3 joue le rôle de catalyseur, c'est un acide
de Lewis.
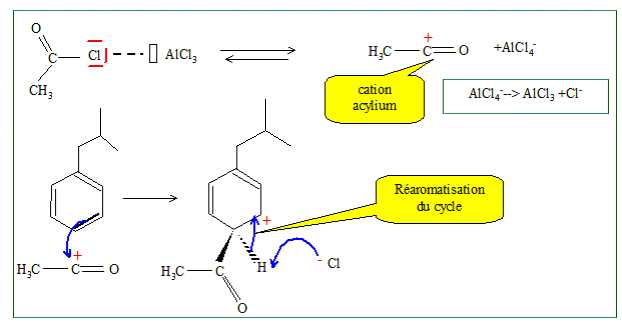
Pourquoi
l'orientation para est-elle favorisée ?
Le cycle benzénique possède déja un substituant ( -CH2-CH(CH3)2,
très encombrant. Il y a gène stérique en positions ortho.
Donner
la formule semi-développée des composés B, C, D et E.
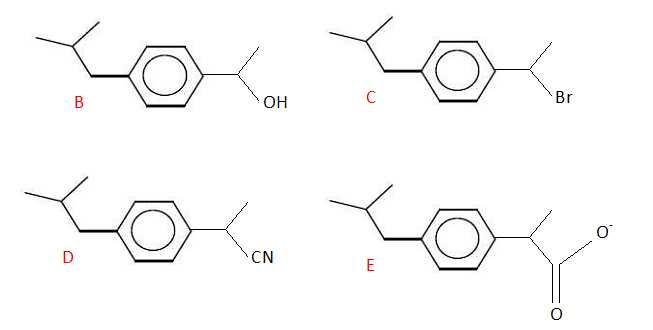
|
.
|
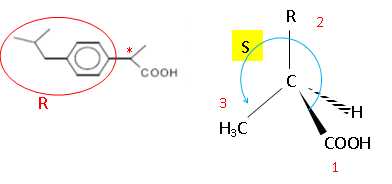
La synthèse de l'ibuprofène conduit à
un mélange racémique.
Indiquer
le carbone asymétrique et dessiner l'énantiomère S, qui est la molécule
active, en représentation de Cram.
A la fin de synthèse le (
+/-)-ibuprofène est purifié par recristallisation.
Expliquer
le principe de cette méthode de purification.
Dissoudre
à chaud le solide dans le minimum de solvant. Les impuretés doivent
être solubles à chaud comme à froid dans ce solvant. Laisser refroidir,
l'ibuprofène cristallise. Filtrer sur Büchner.
Citer
d'autres techniques de purifications applicable dans ce cas.
Extraction
par solvants.
Quelle
mesure physique permet de vérifier la pureté du composé ?
La mesure du point de fusion.
Les spectres RMN 1H et 13C
découplé proton sont représentés ci-dessous :
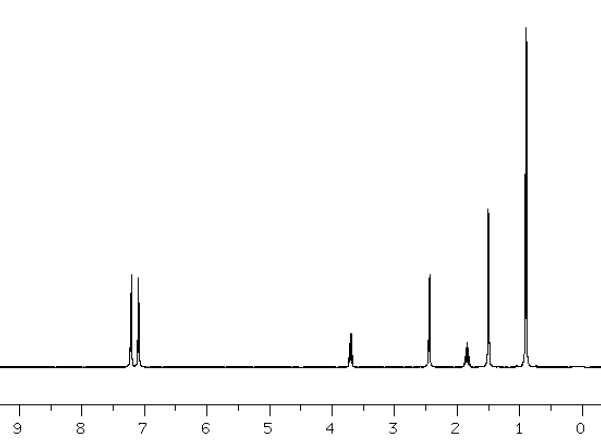
Attribuer
les signaux observés pour les déplacements chimiques suivants
:
d
=7,2 ppm, doublets, 2H : protons du cycle aromatique situés en ß du
carbone asymétrique. ( effet déblidant du groupe COOH ).
d =3,7
ppm, multiplet, 1H : proton situé en a du groupe COOH
couplé avec les protons du groupe méthyle.
d =0,9
ppm, doublet, six protons équivalents ( 2 groupes méthyles) couplé avec
un autre proton. -CH(CH3)2.
|
|
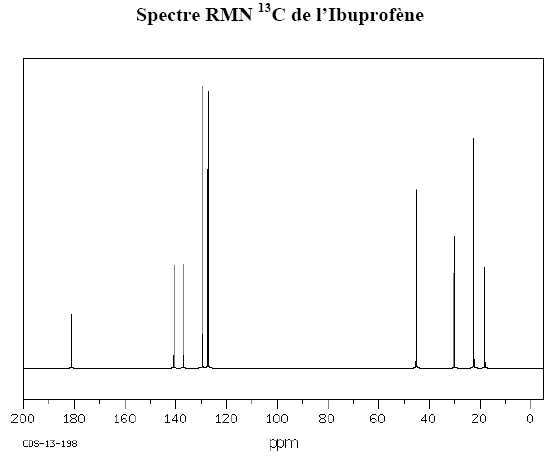
Attribuer
les signaux observés pour les déplacements chimiques suivants
:
d
= 181,11 ppm : atome de carbone du groupe COOH.
d
= 129 ppm : atomes de carbone du cycle aromatique.
d
= 127 ppm : atomes de carbone du cycle aromatique.
Pourquoi
doit-on enregistrer le spectre découplé protons ?
Suppressions des éclatements de résonance dues aux couplages avec les protons.
L'ibuprofène
soumis aux traitements thermiques et oxydant conduit à divers produits
de dégradation caractérisés par GC / MS.
Sur
le schéma ci-dessous, identifier les différentes parties d'un appareil
de chromatographie en phase gazeuse équipé d'un détecteur FID.
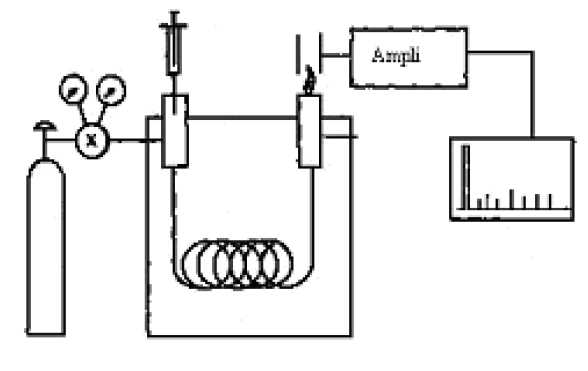
A droite, le gaz vecteur et l'injecteur ; au centre, la colonne placée dans une enceinte thermostatée ; à gauche, le détecteur.
Citer
d'autres types de détecteur utilisés en chromatographie en phase gazeuse.
- détecteur à
ionisation de flamme : très sensible.
- détecteur électrique, basé sur le principe du pont de Wheatstone (
catharomètre ).
- détecteur à absorption électronique.
- spectromètre de masse et la spectroscopie infrarouge.
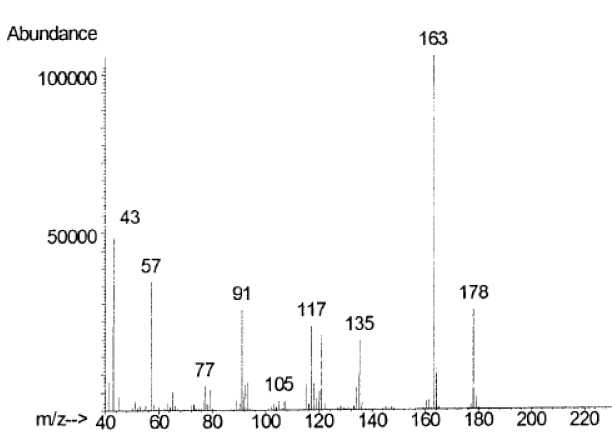
Les
spectres de masse obtenus lors de l'analyse GC/MS par impact
électronique ( IE 75 eV) ont permis la caractérisation des différents
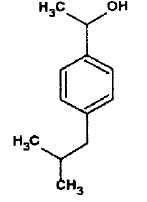
produits de dégradation de l'ibuprofène et entre autre le composé 2
ci-contre. ce composé est associé à l'un des spectres de masse
présentés ci-dessous. Lequel ?
Justifier.
M(C12H18O)=12*12+18+16=178
g/mol. ( pic moléculaire).
m/z = 163 : pic le plus stable associé à : 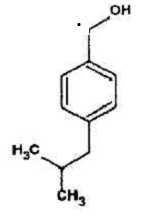 m/z = 43,
associé à (CH3)2CH. m/z = 43,
associé à (CH3)2CH.
m/z = 57,
associé à (CH3)2CH-CH2. ;
 |
 |
|
|







 m/z = 43,
associé à (CH3)2CH
m/z = 43,
associé à (CH3)2CH
