|
|
|
|
Cinétique.
Les ions iodure I- réagissent avec les ions peroxodisulfate S2082-.
L'équation associée à la réaction s'écrit:
2I-(aq) + S2082-aq ---> I2(aq)+ 2 SO42-(aq)
A t = 0, on réalise un mélange réactionnel S à partir d'une quantité de
matière d'ions iodure n1 = 5,0.10-3 mol et d'un
volume V2 = 10,0 mL de solution aqueuse de peroxodisulfate
de sodium (2Na+(aq)+ S2082-aq) de concentration molaire en soluté apporté C2=
5,0.10-3 mol.L-1. La courbe ci-dessous représente
l'évolution de l'avancement x en fonction du temps t.
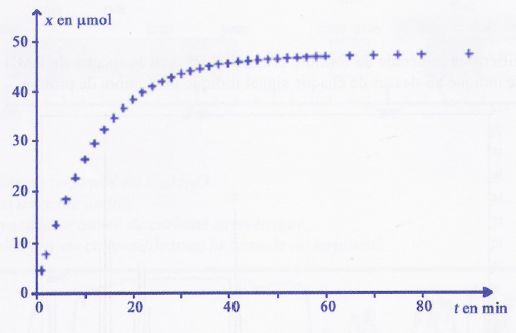
a) Si la température augmente, la valeur de l'avancement maximal Xmax
sera plus importante. Faux.
L'avancement final sera
plus rapidement atteint, la température étant un facteur cinétique.
b) Pour obtenir, à l'instant t = 10 min, un avancement x égal à 0,015
mol, on peut utiliser un catalyseur. Faux
Xmax
ne peut pas être supérieur à 50 µmol, l'ion peroxodisulfate étant le
facteur limitant.
c) Le temps de demi-réaction est égal à environ 5 minutes. Faux.
d) A l'instant t = 20 minutes, la quantité de matière restante en ions
peroxodisulfate est égale à environ 12 µmol. Vrai.
L'avancement est proche
de 38 µmol.
Isomères
:
Les formules topologiques de deux molécules A et
B sont données ci-dessous.
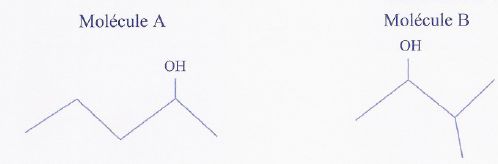
a) La formule brute de la molécule A est : C5H11O.
Faux.
La molécule ne comptant
que des atomes de carbone, hydrogène et oxygène, le nombre d'hydrogène
est pair. C5H12O.
b) La molécule B est un isomère de la molécule
A. Vrai.
c) La molécule A ne possède pas de diastéréoisomères. Vrai.
Il n'y a pas de double
liaisons carbone - carbone.
d) La molécule A n'a que deux conformères. Faux.
On passe d'un conformère
à un autre pas simple rotation autour d'une liaison simple carbone
carbone : il y a de nombreuses conformations.
|
.
|
IR.
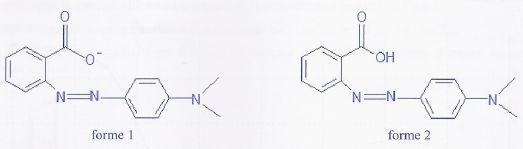
Le rouge de méthyle est un indicateur coloré. Sa teinte est rouge en
milieu très acide et jaune en milieu basique.
On a représenté ci-dessous la formule topologique des deux formes acide
et basique présentes dans une solution aqueuse de cet indicateur coloré.
Donnée : constante d'acidité du couple (forme 2 / forme 1) : Ka
= 10-5,2.
a) La masse molaire ionique de la forme 1 est égale à 268 g/mol. Vrai.
C15
H14O2N3-
: M =12*15 +14 +32 +3*14 =268 g/mol.
b) Lorsque la forme 2 est prépondérante, la solution a une teinte
jaune. Faux.
La forme 2 est la plus
protonée, donc présente en milieu très acide : sa teinte est rouge.
c) La forme 1 absorbe essentiellement dans le bleu.Vrai
La forme 1 a une teinte jaune, elle absorbe la couleur complémentaire
du jaune, c'est à dire le bleu.
d) A pH =4,2, [forme 2] / [forme 1] = 0,10. Faux.
pKa
= 5,2.pH = pKa + log [forme 1] / [forme 2] ;
log
[forme 1] / [forme 2] = 4,2 -5,2 = -1 ; [forme 1] / [forme 2] =0,10.
|
|
Dosage.
On désire doser l'acide ascorbique C6H806
contenu dans un comprimé de vitamine C. On écrase un demi comprimé de
vitamine C dans un mortier. On introduit la poudre dans une fiole
jaugée de 100 mL, on
complète avec de l'eau distillée, on obtient la solution S. On prélève
10 mL de la solution S que l'on dose avec une solution d'hydroxyde de
potassium (K+(aq)+ HO-(aq)) de concentration
molaire c = 1,0.10-2 mol.L-1.
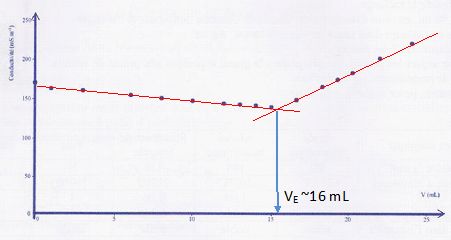
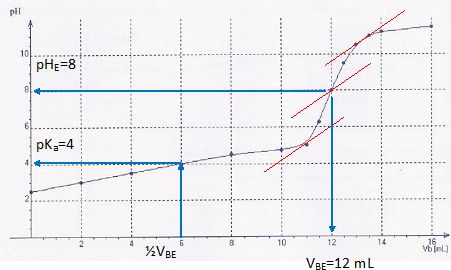
La courbe de ce titrage pH-métrique est représentée ci-dessous, où Vb
est le volume d'hydroxyde de potassium versé.
Données : couples acide/base intervenant au
cours du dosage: C6H806(aq) / C6H706-(aq)
et H2O(1/)HO-(aq); masse molaire moléculaire de C6H806 : M = 176 g/mol.
a) La valeur du pKa du couple auquel appartient l'acide
ascorbique est voisine de 4. Vrai.
b) L'acide ascorbique est un acide fort. Faux.
Le pH à l'équivalence
n'est pas égal à 7, ( la potasse est une base forte ).
c) Un comprimé contient plus de 250 mg de vitamine C. Vrai.
A l'équivalence n(C6H806 ) = c VBE
=0,010 *12 10-3 = 1,2 10-4
mol dans 10 mL soit 1,2 10-3 mol dans 100 mL soit 2,4 10-3
mol dans un comprimé.
m = 2,4 10-3
* 176 =0,42 g.
Il existe quatre stéréoisomères de configuration a, b, c, et d de
l'acide ascorbique dont l'un est la vitamine C.
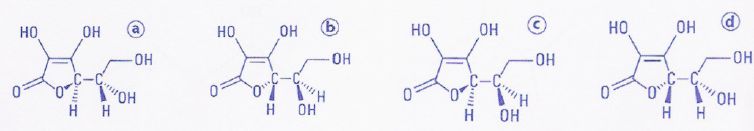
Parmi les quatre
stéréoisomères de configuration de l'acide ascorbique a et c sont
diastéréoisomères. Faux.
En dehors du cycle il n'y a pas
de liaison C=C, donc a et c ne sont pas diastéréoisomères.
|
|