|
|
|
|
Classer ces solvants
par ordre croissant de leur température d'ébullition.
Ether (34°C ) ; acétone (54°C ) ; éthanol (78°C ) ; eau ( 100 °C ).
Sous une pression de 1 bar.
Compléter
le tableau suivant :
Formule
|
Nom
|
Formule
|
Nom
|
K2Cr2O7
|
dichromate
de potassium
|
AgNO3
|
nitrate d'argent
|
H3PO4
|
acide phosphorique
|
CH3COOH
|
acide éthanoïque ( acétique )
|
KI
|
iodure
de potassium
|
CuSO4
|
sulfate
de cuivre
|
Compléter le tableau
en indiquant si les mélanges sont miscibles ou non miscibles.
Mélange
|
Miscible
|
Non
miscible
|
Eau
/ métanol
|
miscible
|
|
Eau
/ décane
|
|
Non
miscible
|
Eau
/ éther
|
|
Non
miscible
|
Citer deux éléments
:
Alcalins : sodium, potassium.
De transition : fer, manganèse.
Halogènes : brome, chlore.
Gaz rares ( nobles) : hélium, néon.
Quelles sont les
fonctions notées A, B, C et D dans la molécule suivante ?
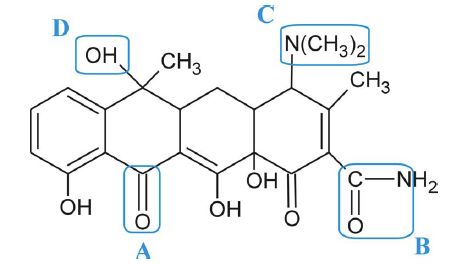
A) Cétone ; B) Amide ; C) Amine tertiaire ; D) Alcool secondaire.
Quel
solvant choisiriez-vous pour solubiliser au mieux les composés suivants :
NaCl : eau ; Al(OCH3)3
: méthanol ;  octane. octane.
|
.
|
Compléter le tableau
en indiquant par 1 l'état de départ et par 2 l'état d'arrivée pour les
changements suivants :
|
Solide
|
Liquide
|
Gaz
|
Sublimation
|
1
|
|
2
|
Fusion
|
1
|
2
|
|
Solidification
|
2
|
1
|
|
Décrire brièvement
deux méthodes de cristallisation.
Cristallisation par refroidissement : l'abaissement de la température
provoque la diminution de la solubilité du produit en solution.
Cristallisation par évaporation : l'évaporation du solvant
provoque l'augmentation de la concentration du produit en solution ce
qui entraîne sa cristallisation ( méthode utilisée dans les marais
salants ).
Décrire brièvement
deux méthodes permettant de purifier une molécule dissoute en solution.
Recristallisation
: dissoudre à chaud le produit solide dans le minimum de solvant ( les
impuretés doivent être solubles à chaud comme à froid) puis laisser
refroidir. Filtrer ensuite.
Extraction par solvants : les solvants doivent être non miscibles et
l'espèce à ectraire doit être très soluble dans l'un des solvants et
beaucoup moins dans l'autre.
Convertir
100 nm en m.
100 nm = 100 10-9 m = 10-7 m.
Quelle
est la taille approximative d'une petite molécule ( éthanol,
eau, méthane ) ?
0,001 nm ( Faux ) ; 1 nm ( Vrai ) ; 100 nm ( Faux).
Qu'appelle-t-on
nanoparticule ?
Une nanoparticule est un élément dont les dimensions sont comprises
entre 1 nm et 100 nm.
Quels
sont les risques potentiels liés à la manipulation des nanoparticules
?
Les nanoparticules sont absorbées avant tout
par les voies respiratoires d'où elles peuvent passer dans les cellules
ou dans le sang. Elles peuvent être à l’origine de réactions
inflammatoires. Les nanotubes de carbone ont un effet cancérigène.
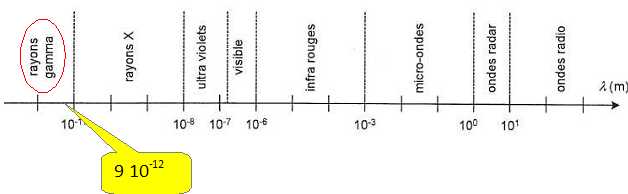
Placer
approximativement les domaines suivants sur l'axe des longueurs d'onde.
Visible, infra-rouge, ultra-violet, tayons X.
|
|
Réaction entre
le zinc et l'acide chlorhydrique.
Couples redox Zn2+aq/ Zn(s) ; H3O+aq /
H2(g).M(Zn) = 65,4 g/mol ; Vm = 24,3 L / mol.
Masse de zinc m = 1,89 g.
A la date t on a récupéré V=125 mL de gaz. Quelle est la masse de zinc
consommée ?
Quantité
de matière de dihydrogène : n = V / Vm = 0,125/24,3 = 5,14 10-3
mol.
Zn(s) = Zn2+aq + 2e- ; 2H3O+aq
+ 2e- = H2(g) + 2H2O(l).
Bilan : Zn(s) +2H3O+aq = Zn2+aq +H2(g)
+ 2H2O(l).
Quantité de matière de zinc n = 5,14 10-3 mol ; masse de
zinc consommée : 5,14 10-3 *65,4 = 0,336 g.
Quel est le volume maximal de gaz que l'on peut récupérer ?
n(Zn) = m / M(Zn) = 1,89 / 65,4 = 2,89 10-2 mol.
n(H2) = n(Zn) = 2,89 10-2 mol.
Volume de dihydrogène récupérable : n(H2) Vm =
2,89 10-2 *24,3 =0,70 L.
|
|