|
|
|
|
Noms,
représentations et réactions.
Représenter (
représentation spatiale ) les molécules suivantes puis entourer et
nommer le groupe fonctionnel.
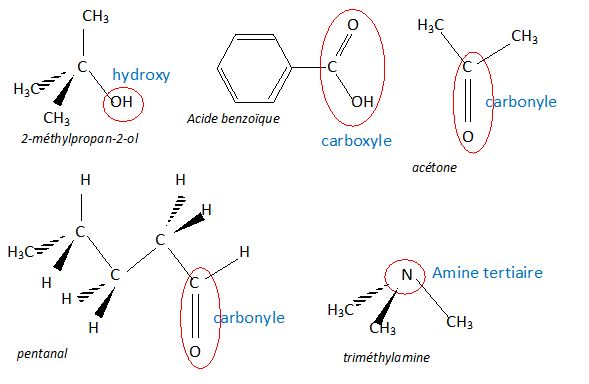
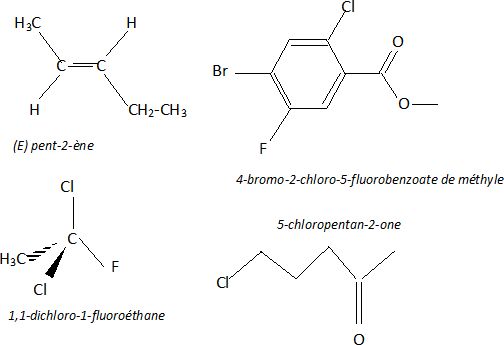
Nommer
les 5 molécules suivantes.
KHCO3 : hydrogénocarbonate de potassium.
Equilibrer
ces deux réactions.
Cu(s) + 2H2SO4 aq, concentré ---> CuSO4aq
+ SO2(g) +2H2O(l).
5Fe2+aq + MnO4- +8H3O+aq
---> 5Fe3+aq + Mn2+aq +12 H2O(l).
Concentration
molaire.
Sur l'étiquette d'un flacon d'acide chlorhydrique on lit : pourcentage
massique 40 % ; densité : 1,189 ; M =36,47 g/mol.
Calculer la
concentration molaire de cette solution.
Masse de 1 L de solution : 1189 g.
Masse d'acide chlorhydrique : 1189*0,40 =475,6 g
Concentration : 475,6 / 36,47 =13,0 mol/L.
|
.
|
Préparation du
benzoate de méthyle.
On introduit 12,2 g d'acide benzoïque C6H5-COOH,
3,2 g de méthanol CH3OH, 3 mL d'acide sulfurique concentré
et quelques grains de pierre ponce dans le ballon de 100 mL d'un
chauffage à reflux. On chauffe pendant une heure sous hotte. On verse
ensuite le contenu du ballon dans un becher contenant le mélange
eau-glace. Il se forme alors deux couches liquides non miscibles.
Ecrire
l'équation de la réaction se produisant dans le ballon.
C6H5-COOH
+CH3OH =C6H5-COOCH3+H2O.
Comment
s'appelle ce type de réaction ?
Estérification.
A
quoi sert l'acide sulfurique ?
Catalyseur.
Faire
un schéma illustrant le chauffage à reflux.
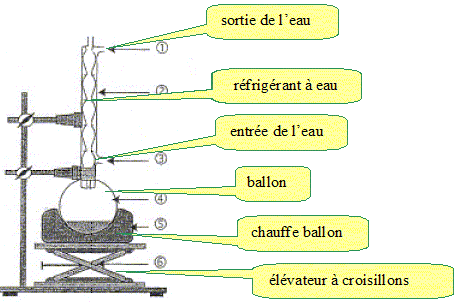
Quel
est le rôle de la pierre ponce ?
La pierre ponce régularise l'ébullition.
Quelle
est l'utilité de ce montage et pourquoi se placer sous la hotte ?
Le chauffage à reflux permet d'accélérer la réaction en travaillant à
température modérée tout en évitant les pertes de matière. Les vapeurs
se condensent dans le réfrigérant et retombent dans le milieu
réactionnel.
Le méthanol est volatil et toxique : il faut travailler sous hotte.
La phase organique ayant une densité supérieure à celle de la phase
aqueuse, proposer
une méthode simple pour séparer les deux phases.
Utiliser une ampoule à décanter.
On obtient 8,1 g de benzoate de méthyle.
Quelle
serait la masse obtenue si la réaction était totale et quel est le
rendement ?
Quantité de matière :
acide benzoïque 12,2 / (7*12+6+32) =0,10 mol
de méthanol : 3,2/(12+4+16)=0,10 mol.
On peut espérer obtenir au mieux 0,10 mol d'ester soit 0,10*(8*12+32+8)
=13,6 g d'ester si la réaction est totale.
Rendement : 8,1 / 13,6 ~0,60 ( 60 %).
En théorie le rendement devrait être de 67 %.
Comment
expliquer l'écart entre la valeur expérimentale et la valeur théorique
?
Le benzoate de méthyle est faiblement soluble dans l'eau ; une partie
n'a pas été extraite lors de la décantation.
|
Dosage
du sildenafil par HPLC.
Que signifie HPLC
?
Chromatographie liquide haute performance.
Citer les 4
principaux modules constituant une chaîne HPLC.
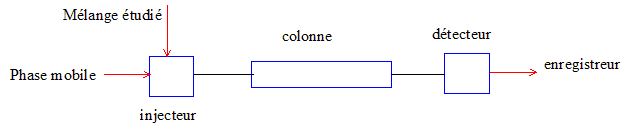
On travaille en phase
stationnaire inverse et un détecteur qui mesure l'absorbance des
longueurs d'ondes comprises entre 200 et 400 nm.
On donne le spectre de la molécule de
sildéfanil.
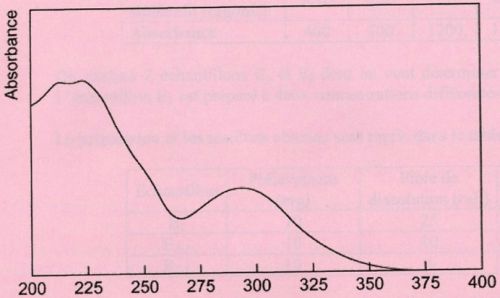
Définir
phase inverse et phase normale.
- phase normale : gel de silice polaire ; on utilise un
éluant apolaire ; les produits polaires sont retenus dans la colonne,
les produits apolaires sortent en premiers.
- phase inverse : phase fixe apolaire ; éluant polaire ;
les molécules polaires sortent en premier.
Quel
type de détecteur est utilisé et à quelle longueur d'onde doit-on le
régler ?
Le détecteur UV visible sera régler sur la longueur d'onde
correspondant au maximum d'absorption, environ 225 nm.
Justifier
" la phase mobile est constituée d'un mélange eau acétonitrile".
La phase fixe étant apolaire, la phase mobile doit être polaire.
Pour valider la méthode, on a, entre autres, fait une répétabilité, une
reproductibilité et déterminer les limites de quantification et de
détection qui sont respectivement de 0,1 mg/mL et de 0,03 mg/mL.
Expliquer
ce que sont répétabilité et reproductibilité.
Répétabilité : les résultats d'essai indépendants sont obtenus par la
même méthode sur des individus d'essai identiques dans le même
laboratoire, par le même opérateur, utilisant le même équipement et
pendant un court intervalle de temps.
Reproductibilité : les
résultats d'essai sont obtenus par la même méthode sur des individus
d'essais identiques dans différents laboratoires, avec différents
opérateurs et utilisant des équipements différents.
Expliquer
ce que sont les seuils de détection et de quantification.
La limite de détection d'une méthode est la plus basse concentration
d'un composé produisant un signal détectable avec une fiabilité définie
différent de celui produit par un « blanc » dans les mêmes conditions
expérimentales.
Le seuil de détection est la plus faible concentration d’un produit à
analyser dans un échantillon qui
puisse être quantifiée avec précision et exactitude acceptables dans des conditions
expérimentales données.
On réalise une courbe d'étalonnage en 5 points ( 0,10 mg/mL ; 0,25
mg/mL ; 0,50 mg/mL ; 0,75 mg/mL ; 1,00 mg/mL )
Les échantillons et les témoins sont dissous dans un mélange
acétonitrile eau ( 50 / 50 ). On dispose de témoins en poudre de
citrate de sildénafil monohydraté dont la pureté est de 99 %.
Expliquer les calculs et la procédure à suivre pour préparer les 5
solutions. La colution mère à 1,00 mg/mL est dans une fiole jaugée de
25 mL.
0,75 mg/mL
: facteur de dilution 1/0,75 = 1,33 ; prélever 3,75 mL de
solution mère et compléter une fiole jaugée de 5 mL avec le solvant eau
acétonitrile ( 50 / 50 ).
0,50 mg/mL
: facteur de dilution 1/0,50 = 2 ; prélever 2,50 mL de solution
mère et compléter une fiole jaugée de 5 mL avec le solvant eau
acétonitrile ( 50 / 50 ).
0,25 mg/mL
: facteur de dilution 1/0,25 = 4 ; prélever 1,25 mL de solution
mère et compléter une fiole jaugée de 5 mL avec le solvant eau
acétonitrile ( 50 / 50 ).
0,10 mg/mL
: facteur de dilution 1/0,1 = 10 ; prélever 0,5 mL de solution
mère et compléter une fiole jaugée de 5 mL avec le solvant eau
acétonitrile ( 50 / 50 ).
|
|
On obtient les résultats suivants :
C
: concentration sildénafil ( mg/mL)
|
0,10
|
0,25
|
0,50
|
0,75
|
1,00
|
A
: absorbance
|
400
|
700
|
1200
|
1700
|
2200
|
On analyse 2 échantillons E1 et E2 dont on veut
déterminer la concentration en sildénafil. L'échantillon E2
est préparé à deux concentrations différentes.
Echantillon
|
Prélévement
( mg)
|
Fiole
de dissolution ( mL)
|
Absorbance
|
E1
|
10
|
25
|
2100
|
E2
- 1
|
10
|
10
|
1400
|
| E2
- 2 |
10
|
5
|
2800
|
Donner l'équation et
les caractéristiques de la courbe d'étalonnage.
Concentration et absorbance sont proportionnelles. La courbe est une
droite ne passant par l'origine, l'absorbance de l'acétonitrile n'étant
pas nulle à 225 nm.
A = aC+b.
700 = 0,25 a +b ; 1200 = 0,50 a + b soit 500 = 0,25 a ; a = 2000 et b =
200.
1200 = 0,5 a + b ; 2200 = a+b soit 1000 = 0,5 a ; a = 2000 et b = 200.
A = 2000 C +200.
Calculer
les concentrations en sildénafil dans les échantillons. Pour
l'échantillon E2, quelle
concentration doit-on prendre en compte ? Justifier.
E1 : C = (2100-200) / 2000 =0,95 mg/mL.
E2 - 1 : C =
(1400 -200 ) / 2000 =0,6 mg/mL.
E2 - 2 : C =
(2800 -200 ) / 2000 =1,3 mg/mL. Cette valeur n'est pas à retenir, elle
se situe en dehors de la courbe d'étalonnage.
|




