|
|
|
|
Le
1, 3, 5-trinitrobenzène ( TNB) est un composé organique explosif,
encore plus puissant que le TNT. La nitration du benzène à l'aide
d'acides forts est possible, mais elle est dangereuse à cause de
nombreuses réactions parallèles, ce qui de plus, réduit le rendement.
La méthode habituelle est la décarboxylation de l'acide 2, 4,
6-trinitrobenzoïque lui même produit de l'oxydation du TNT.
Suggérer
une séquence de réactions permettant de préparer le TNB à partir du
toluène. Nommer les produits obtenus à chaque étapes suivant la
nomenclature officielle.
Nitration du toluène à l'aide du mélange acide sulfurique + acide
nitrique concentrés : obtention du 2, 4, 6-trinitrotoluène.
Oxydation du groupe méthyl à l'aide de dichromate de potassium en
milieu acide sulfurique : obtention d'acide 2, 4, 6-trinitrobenzoïque.
Décarboxylation de cet acide : obtention du 1, 3, 5-trinitrobenzène.
En
fin de réaction, le TNB est caractérisé par RMN du proton et du carbone
13 ainsi que par spectrométrie de masse Electrospray et analyse
élémentaire.
Combien
de protons différents et de carbone différents obtient-on en RMN ?
Argumenter.
Du fait de la symétrie les trois protons du
cycle sont équivalents.
Par contre on distingue deux groupes de carbone équivalent : les atomes
de carbones liés aux atomes d'hydrogène et les atomes de carbone liés
au groupe nitro.
Quel sera le pic
moléculaire obtenu par spectrométrie de masse ?
C6H3N3O6 : M =
12*6+3+3*14+6*16 =213 g/mol.
La spectrométrie de masse Electrospray
permet
génére une ionisation "douce" : des ions moléculaires sont formés en
majorité. Le pic moléculaire se trouvera à 213.
Donner la
composition centésimale obtenue par analyse élémentaire.
% C : 72/213*100 = 33,8 % ; %H : 3*100/213 =1,41 % ;
%N : 42*100/213 = 19,7 % ; % O : 96*100/213 =45,1 %.
|
.
|
Lors
d'une perquisition chez un traficant, de la poudre blanche a été
prélevée et envoyée au laboratoire pour analyses. Le composé a été
identifié comme étant de l'héroïne par spectrométrie de masse et RMN du
proton et du carbone.
Sachant que l'héroïne est obtenue par estérification de deux hydroxyles
de la morphine avec de l'anhydride acétique, en présence d'un
catalyseur,
donner
l'équation bilan de la réaction.
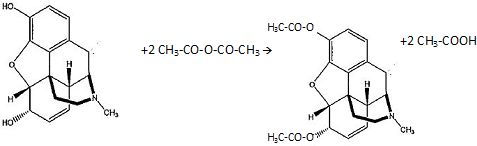
Quel(s) avantage(s)
y a-t-il à utiliser l'anhydride acétique plutôt que l'acide acétique ?
L'estérification
à l'aide d'un acide carboxylique est lente et limitée par l'hydrolyse
de l'ester. Par contre à l'aide d'un anhydride d'acide, la réaction est
rapide et totale.
Les deux hydroxydes
de la morphine ont-ils la même réactivité ? Expliquer.
Les
deux hydroxydes ne sont pas équivalents : l'un est fixé sur le cycle
benzénique ( il s'agit d'un phénol ) et l'autre appartient à la
fonction alcool secondaire.
Leur réactivité sera donc différente.
Le spectre de masse de l'héroïne est le
suivant :
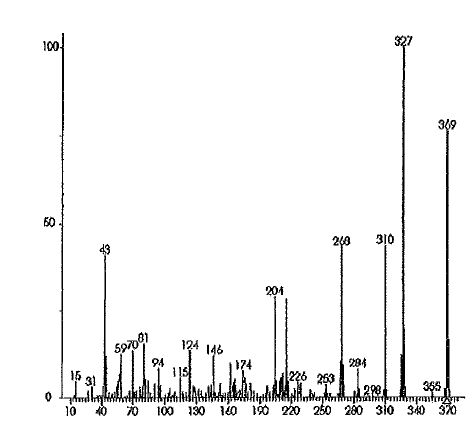
|
|
Rappeler
brièvement le principe de la spectrométrie de masse. Que porte-t-on en
abscisse et en ordonnées sur le spectre précédent ? A quoi correspond le
pic à 327 ?
Un spectrographe de masse
est constitué de plusieurs parties comme l'indique la figure ci-dessous
:
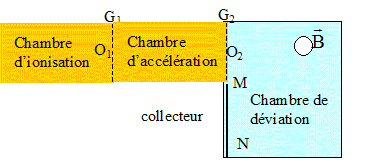
- La
chambre d'ionisation produit des ions de
masses respectives m1 et m2.
On considère qu' à la sortie de cette chambre, en O1,
la vitesse de ces ions est quasi-nulle. On néglige les forces de
pesanteur.
- La chambre
d'accélération dans laquelle les ions sont accélérés entre O1
et O2 sous l'action d'une différence de
potentiel établie entre les grilles G1
et G2.
- La chambre de
déviation dans laquelle les ions sont déviés par un champ magnétique
uniforme B
de
direction perpendiculaire au plan de la figure. Un collecteur constitué
d'une plaque photosensible est disposé entre M et N. Les chambres sont
sous vide.
En abscisse on porte le rapport masse / charge, m / z et en ordonnée le
pourcentage relatif des pics.
Le pic moléculaire est à m/e = 369 ; 369-327 =42.
Ce qui correspond à la perte de CH3-CO et formation de
l'ion phénate stabilisé par résonance.
La codéine, un analgésique léger souvant utilisé comme antitussif, est
aussi synthétisée par monométhylation en milieu basique de la morphine.
Donner
la structure de cette molécule. Expliciter la sélectivité.
Un phénol est plus acide qu'un alcool : l'ion phénate est stabilisé par
résonance.
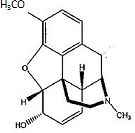
|
|