|
|
|
|
La benzocaïne.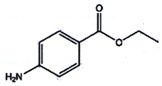
Combien y-a-t-il
d'affirmations exactes ?
- Le nom systématique de la
beenzocaïne est 4-nitrobenzoate de méthyle. Faux.
4-nitrobenzoate d'éthyle.
- La masse molaire de la
benzocaïne est 164 g/mol. Faux.
M (C9H11O2N)=9*12+11+32+14
=135 g/mol ; avec un atome
d'azote la masse molaire est un nombre impair.
- La benzocaïne possède une fonction amine. Vrai ( groupe NH2).
- La benzocaïne possède une fonction acide carboxylique. Faux ( fonction ester ).
- Le pourcentage en masse de carbone dans la benzocaïne est 65,5 %.
Vrai. 9*12 / 165 *100 =65,5 %.
On réalise la synthèse de la benzocaïne en faisant réagir 1,50 g
d('acide 4-aminobenzoïque ( C7H7NO2
) avec 100 mL d'éthanol. Il se forme de la benzocaïne et de l'eau.
Après traitement du milieu réactionnel on obtient 1,37 g de benzocaïne.
Densité de l'éthanol d = 0,81.
Calculer
le rendement ( en %) de cette synthèse. ( 45 ; 58 ; 67 ; 72 ; 76
; aucune réponse exacte )
M(C7H7NO2) =7*12+7+14+32 =137 g/mol
; n1 = 1,50 / 137 =1,09 10-2 mol.
M(éthanol) = 46 g/mol ; m(éthanol) = 100*0,81 = 81 g ; n2 =
81/46 =1,76 mol ( en excès).
On peut donc obtenir au mieux 1,09 10-2 mol de benzocaïne, soit 1,09
10-2 *165 =1,81 g
rendement : 1,37 / 1,81 *100 ~ 76 %.
Le
laiton.
le laiton est un alliage métallique composé de cuivre et de zinc. Un
échantillon de masse m = 1,52 g de laiton est traité par un excès de
solution aqueuse d'acide nitrique concentré. Le cuivre est entièrement
transformé en ions Cu2+ et le zinc en ion Zn2+.
Quand tout le laiton a disparu, on place la solution obtenue dans une
fiole jaugée de 1000 mL et on complète avec de l'eau distillée jusqu'au
trait de jauge. La solution ainsi préparée que l'on notera S1
présente une couleur bleue uniquement due aux ions Cu2+.
On prépare une solution S2 de sulfate de cuivre en
dissolvant une masse de 1,87 g de sulfate de cuivre pentahydraté solide
CuSO4, 5 H2O
dans de l'eau distillée pour obtenir 500 mL de solution. A l'aide d'un
spectrophotomètre on mesure les absorbances des deux solutions : A1
= 1,10 et A2 = 0,98.
Calculer le pourcentage en masse de cuivre dans le laiton. 55 ;
60 ; 65 ; 65 ; 70 ; 75 ; autre.
M(CuSO4,
5 H2O) =63,5 +32 +64 +5*18 =249,5 g/mol.
Quantité de matière d'ion cuivre (II) dans S2 : 1,87 / 249,5
=7,5 10-3 mol.
Concentration des ions cuivre (II) dans S2 : 7,5 10-3 /0,5
=0,015 mol/L.
Concentration des ions
cuivre (II) dans S1 : 0,015 *1,10/0,98 =1,68 10-2
mol/L.
Quantité de matière de cuivre dans le laiton : 1,68 10-2 mol.
Masse de cuivre dans le laiton : 1,68 10-2 *63,5 = 1,07 g soit 107/1,52 = 70
%.
|
.
|
Le
nitrate d'ammonium.
L'ammonitrate est un engrais azoté minéral à base de nitrate d'ammonium
NH4NO3.
L'étiquette d'un engrais indique % massique en azote 33,4 %. le nitrate
d'ammonium est très soluble dans l'eau, sa dissolution est totale
suivant la réaction : NH4NO3(s) --> NH4+aq
+ NO3-aq.
Dans une fiole jaugée de 250 mL on introduit 3,25 g d'engrais solide.
On verse un peu d'eau distillée dans la fiole, on bouche, on agite
jusqu'à dissolution complète de l'engrais. On complète avec de l'eau
distillée jusqu'au trait de jauge, on bouche et on homogénéise la
solution. On note S la solution ainsi préparée. On verse V0=20,0
mL de cette solution dans un erlenmeyer. On dose les ions ammonium à
l'aide d'une solution aqueuse d'hydroxyde de sodium de concentration
molaire apportée C = 0,200 mol/L.
Le pourcentage massique en élément azote est égal au rapport de la
masse d'azote présente dans l'échantillon sur la masse de
l'échantillon. L'azote de l'engrais provient uniquement du nitrate
d'ammonium.
Couples acide / base mis en jeu : NH4+aq
/ NH3aq ; H2O(l) / HO-aq.
Quel est
le volume (mL) d'hydroxyde de sodium versé à l'équivalence ?
12,2 ; 14,1 ; 14,9 ; 15,5 ; 18,2 ; autre.
Masse d'azote dans l'échantillon : 0,334 *3,25 = 1,0855 g.
M(NH4NO3) =28+4+3*16 =80
g/mol.
Masse de nitrate
d'ammonium dans l'échantillon : 80/ 28 *1,0855 =3,10 g.
Quantité de matière de
nitrate d'ammonium dans 250 mL de solution : 3,10 / 80 = 3,875 10-2
mol.
[NH4+aq] =3,875
10-2/0,25 =0,155 mol/L soit 0,155*0,020 = 3,1 10-3
mol dans V0.
NH4+aq
+ HO-aq
--> NH3aq
+H2O(l).
A l'équivalence : n(HO-aq) =3,1 10-3
mol ; V(soude) = n(HO-aq) / C
= 3,1 10-3 / 0,200 =1,55 10-2 L = 15,5 mL
|
|
Solution
aqueuse d'acide chlorhydrique.
On prépare une solution aqueuse d'acide chlorhydrique en dissolvant v =
5,0 L de chlorure d'hydrogène gazeux dans V = 500 mL d'eau distillée.
La dissolution est totale et s'effectue à température de 25°C.
L'équation de dissolution s'écrit : HCl(g) + H2O(l) = H3O+aq
+Cl-aq.
Une solution aqueuse d'acide chlorhydrique est une solution d'acide
fort.
On réalise une solution S en mélangeant V1 = 12 mL de la
solution précédente avec V2
= 18 mL d'une solution aqueuse d'hydroxyde de sodium à C = 0,25 mol/L.
Une solution aqueuse d'hydroxyde de sodium est une base forte. Vm
= 24,0 L/mol.
Quel est le pH de la
solution ? 1,2 ; 1,4 ; 1,8 ; 2,2 ;
7,0 ; autre.
Quantité
de matière de HCl(g) : n = v / Vm = 5,0 / 24 =0,2083 mol.
Quantité de matière d'ion oxonium : n = 0,2083 mol
Concentration de la solution d'acide chlorhydrique : Ca =
0,2083 / 0,500 =0,4167 mol/L.
H3O+aq + HO-aq --> 2 H2O(l).
n(H3O+aq)initial=CaV1 =0,4167 *0,012 =5,0 10-3
mol ;
n(HO-
aq)initial=CV2 =0,25 *0,018 =4,5,0 10-3
mol ( en défaut ).
n(H3O+aq)final=5,0 10-3 - 4,5 10-3 =5,0 10-4 mol dans 12+18 = 30 mL.
[H3O+aq]final=5,0 10-4 / 0,030 =1,67 10-2
mol/L ; pH = - log(1,67 10-2) =1,8.
|
|
