Synthèse du
paracétamol. Bac S Afrique 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
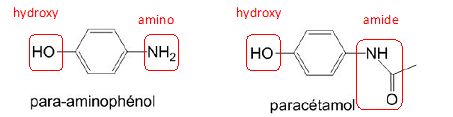
Entourer les groupes caractéristiques et préciser les familles de composés du para-aminophénol et du paracétamol.
Le para-aminophénol appartient à la famille des phénols ainsi qu'à celle des amines aromatiques.
Le paracétamol appartient à la famille des amides ainsi qu'à celle des phénols.
Identifier en justifiant, les sites donneurs de doublets d'électrons présents sur la molécule de para-aminiphénol.
L'atome d'azote et l'atome d'oxygène sont électronégatifs et de plus possèdent des doublets électroniques non liants.
Ce sont des sites riches en électrons.
Le mécanisme simplifié de la réaction de synthèse du paracétamol peut être modélisé par trois étapes.
Etape 1 : représenter la ( les) flèche(s) courbe(s) qui rende(nt) compte de l'obtention de l'intermédiaire A. Justifier.
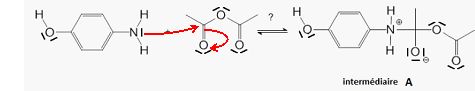
Le carbone du groupe carbonyle de l'anhydride éthanoïque est
déficitaire en électrons. C'est un site accepteur de doublet
d'électrons tandis que l'atome d'azote est donneur.
Indiquer la catégorie de chacune des réactions des trois étapes du mécanisme.
L'étape 1 est une addition sur le groupe carbonyle.
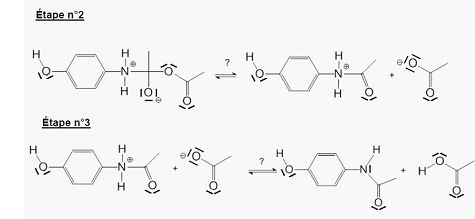
L'étape 2 est une élimination de l'ion éthanoate.
L'étape 3 est un transfert de l'un des hydrogènes portés par l'atome d'azote sur l'oxygène de l'ion éthanoate. ( réaction acide base).
Un autre déplacement de doublets d'électrons pourrait intervenir dans l'étape 1 et produire un intermédiaire B différent de A.
Représenter
ce déplacement de doublet d'électrons et, en supposant deux étapes
analogues aux étapes 2 et 3, donner la formule topologique du produit
final E qui serait alors formé.
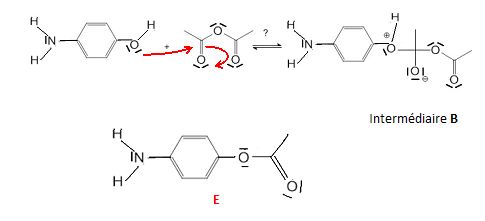
En réalité seul le paracétamol est obtenu. Quelle propriété possède donc cette réaction entre le para-aminophénol et l'anhydrise éthanoïque ?
Le groupe amine réagit majoritairement avec l'anhydride. Cette réaction
est sélective. L'anhydride est un réactif chimiosélectif.
|
| .
. |
|
|
Donner un nom à chacune des 5 phases du protocol expérimental de synthèse.
Phase 1 : dissolution à chaud, avec agitation, de 2,7 g de para-aminophénol dans 25 mL d'eau distillée et 2 mL d'acide éthanoïque pur.
Phase 2
: chauffage avec reflux du milieu réactionnel ; après
refroidissement à température ambiante, ajouter 3,5 mL d'anhydride
éthanoïque au mélange, adapter un réfrigérant à air et placer au bain
marie à 80°C.
Phase 3 : cristallisation complète et filtration sur Büchner, séparation du produit du mélange réactionnel.
Phase 4 : purification du produit par recristallisation, puis filtration et séchage des cristaux.
Phase 5 : identification du produit obtenu par chromatographie ( les étalons étant le paracétamol du commerce et le para-aminophénol ).
|
.
|
|
Justifier le choix des techniques utilisées dans les phases 3 et 4 du protocole expérimental.
Phase 3
: le para-aminophénol et le paracétamol sont très peu solubles dans
l'eau à 0°C. L'anhydride éthanoïque et l'acide éthanoïque sont par
contre très solubles dans l'eau.
En refroidissant le mélange réactionnel la paracétamol et l'éventuel excès de para-aminophénol cristallisent.
La filtration sur Büchner permet la séparation des cristaux de la phase aqueuse.
Phase 4 : purification par recristallisation.
On dissout les cristaux à chaud dans le minimum d'eau distillée puis on laisse refroidir. Le
paracétamol cristallise. On élimine les traces d'eau en plaçant ces
derniers dans un étuve à 80°C. (température de fusion du paracétamol
supérieure à 150 °C).
Déterminer la masse maximal de paracétamol obtenu.
M( para-aminophénol) = 109 g/mol
Quantité de matière de para-aminophénol n =m / M = 2,7 / 109 =2,477 10-2 ~2,5 10-2 mol.
M ( anhydride éthanoïque) =102 g/mol ; densité d = 1,08 ; volume V = 3,5 mL
Quantité de matière d'anhydride éthanoïque n' =d V / M' = 1,08*3,5 / 102 =2,477 10-2 ~2,5 10-2 mol.
La réaction s'effectuant mole à mole, l'anhydride est en excès.
On peut donc espérer obtenir au mieux 2,477 10-2 mol de paracétamol ( M = 151 g/mol).
Masse correspondante : 2,477 10-2 *151 =3,7 g.
|
|
|