Valorisation du dioxyde de
carbone.
Bac S
2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Un
groupe d’élèves a comparé la « neutralisation » des eaux alcalines par
un acide minéral et par le dioxyde de carbone à l’aide d’un logiciel de
simulation.
Dans cette simulation, les eaux usées alcalines sont modélisées par une solution aqueuse d’hydroxyde de sodium (Na+(aq) + HO-(aq)) notée S, de concentration molaire apportée c = 1,0 × 10-3 mol.L-1.
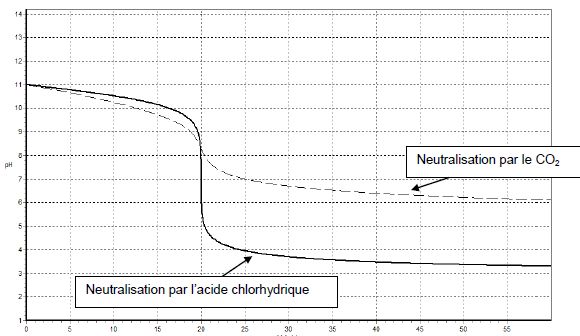
Le document suivant montre l’évolution du pH de la solution S lorsqu’on
ajoute une solution acide. Les solutions acides utilisées sont d’une
part, une solution d’acide chlorhydrique (H3O+(aq) + Cl-(aq)), d’autre part une solution aqueuse de dioxyde de carbone (H2O, CO2(aq)), de mêmes concentrations molaires apportées cA = 1,0 × 10-3 mol.L-1.
Écrire l’équation de la réaction qui se produit lors de l’ajout de l’acide chlorhydrique dans la solution S.
H3O+(aq) + HO-(aq) ---> 2H2O(l).
Dans le cas de la neutralisation par le dioxyde de carbone, quelle est l’espèce carbonatée qui prédomine (parmi CO32-, HCO3- et CO2) à l’équivalence du titrage ? Justifier.
Le pH du point équivalent est voisin de 8,5.
H2O, CO2 (aq) / HCO3- (aq) : pKA1 = 6,4 (à 25 °C)
HCO3- (aq) / CO32- (aq) : pKA2 = 10,3 (à 25 °C).
A pH compris entre pHa1 et pKa2, l'ion hydrogénocarbonate HCO3- (aq) est majoritaire.
En déduire l’équation de la réaction lors de l’ajout de la solution de dioxyde de carbone dans la
solution S.
H2O, CO2 (aq) +HO-(aq) ---> HCO3- (aq) +H2O(l).
Comparer les points d’équivalence et interpréter le résultat.
Le volume équivalent est le même VE = 20 mL ; par contre les pH des points équivalents sont différents :
pH = 7 ( titrage acide chlorhydrique par la soude ) et pH = 8,5 ( titrage de la soude par le dioxyde de carbone aqueux ).
Soit VE le volume à l’équivalence. Pour les deux neutralisations, évaluer graphiquement les variations du pH autour de VE ± 2 gouttes. En déduire la neutralisation la plus adaptée au traitement des eaux usées.
Titrage
de l' acide chlorhydrique par la soude : la courbe est verticale
: dpH / dV est grand ; le pH varie d'environ 3 unités ( 5,5 à 8,5) au voisinage du
point équivalent. L'eau rejetée risque d'avoir un pH trop faible.
Titrage de la soude par le dioxyde de carbone dissous : la courbe est
moins inclinée sur la verticale : dpH/dV est plus petit ; le pH varie
d'environ une unité au voisinage du point équivalent.
L'eau rejetée aura un pH voisin de 8. La neutralisation par le dioxyde de carbone est la plus adaptée.
|
| .
. |
|
|
Comment réduire le dioxyde de carbone dans l’atmosphère et le valoriser ?
Le CO2 est
un des gaz contribuant à l'efet de serre. Le dioxyde de carbone
joue un rôle majeur sur le climat de la terre.L'augmentation de la
demande énergétique ne permet pas actuellement de s'affranchir des
énergies fossiles.
Actuellement le CO2 est valorisé soit de manière directe, par exemple en étant utilisé comme gaz réfrigérant, soit de manière indirecte. Le CO2 est alors converti en un autre produit industriel. L'hydrogénation du CO2 (
réaction avec le dihydrogène et production d'eau dite réaction de
Sabatier ) est la voie de conversion la plus étudiée. Elle peut
conduire directement à la formation d'alcools, d'hydrocarbures... C'est
ainsi que les synthèse du méthanol, de l'éthanal CH3-CH
sont souvent envisagées, de même que la réaction qui mêne au méthane.
Cette dernière implique toutefois une plus large consommation de
dihydrogène.
La production d'électricité avec ce méthane serait préférable, elle permettrait le recyclage des émissions de CO2 ; alors que l'utilisation du méthane comme carburant pour véhicule n'autoriserait pas ce recyclage car les émissions de CO2 sont diffuses.
|
.
|
|
Les techniques visant à réduire les émissions de CO2 concernent
les sources concentrées ( centrales thermiques, sidérurgie,
cimenteries). D'autres techniques visent à améliorer l'efficacité
énergétique des procédés.
La
valorisation du dioxyde de carbone permet sa transformation et rapporte
de l'argent ; le stockage géologique n'élimine pas le CO2 et coûte cher.
Sans transformation le dioxyde de carbone est utilisé en tant que solvant et réfrigérant. ( procédé d'extraction supercritique )
En
réagissant avec une autre espèce chimique, le dioxyde de carbone
conduit à un produit à valeur énergétique plus grande que le CO2 ( synthèse de l'urée )
Par la photosynthèse les algues conduisent à des produits de grand intérêt.
|
|
|