Les fourmis
détiennent-elles la clé du carburant du futur ? Bac S Nlle
Calédonie 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
D'après
le communiqué de presse de l'école polytechnique fédérale de Lausanne
du 30 /11 / 2010. ( Journaliste / Lionnel Pousaz ).
L'hydrogène est
souvent désigné comme le futur remplaçant des carburants fossiles. Il
est facilement produit à partir d'énergie électrique. Ecologique et
performant, il n'en présente pas moins de nombreux inconvénients.
Extrémement inflammable, il doit être stocké dans d'encombrantes
bouteilles pressurisées. Autant d'obstacles à son utilisation, que les
scientifiques de l'EPFL et leurs confrères du Leibniz-Institut für
Catalyse ont levés, en stockant l'hydrogène sous forme d'acide
formique. Grâce à un catalyseur et au CO2 présent dans l'atmosphère, les scientifiques ont transformé l'hydrogène en acide formique.
Plutôt qu'une lourde bouteille en fonte remplie d'hydrogène sous
pression, ils obtiennent ainsi une substance très peu inflammable et
liquide à température ambiante. Une solution pour accumuler l'énergie
des sources renouvelables comme le solaire ou l'éolien, ou alimenter la
voiture de demain.
En novembre 2010 seconde étape. Les laboratoires sont parvenus à
provoquer le phénomène inverse : par le biais d'une catalyse, l'acide
formique retourne de manière totale àl'état de CO2 et
d'hydrogène, lequel peut ensuite être transformé en énergie électrique.
Un prototype fonctionnel, peu encombrant et d'une puissance de 2 kW est
d'ores et déja au point.
Stocker les énergies renouvelables.
Imaginez par exemple que vous ayez des cellules solaires sur votre
toit. Par mauvais temps ou durant la nuit, votre pile à combustible ( H2, O2)
vous permet de restituer le trop plein d'énergie accumulé quand le
soleil brillait. Dans une telle configuration, le procédé permet de
restituer plus de 60% de l'énergie électrique de départ. Cette solution
est extrèmement sûre. L'acide formique libère de manière continue de
très petites quantités d'hydrogène, juste ce dont vous avez besoin sur
le moment pour votre consommation électrique, relève le chercheur.
Autre avantage par rapport au stockage conventionnel, le procédé
permet de stocker presque le double d'énergie à volume égal. En effet,
un litre d'acide formique peut libérer par une transformation chimique
plus de 53 g d'hydrogène, contre àpeine 28 g pour un même volume
d'hydrogène pur pressurisé à 350 bars.
Enfin, les chercheurs ont travaillé sur un procédé de catalyse basé sur
le fer, métal facilement disponible et peu coûteux en comparaison des
métaux nobles comme le platine ou le ruthénium.
De l'acide formique à la pompe.
C'est sans doute dans le domaine de l'automobile que l'invention
présente les potentiels les plus intéressants. Actuellement, les
prototypes produits par certaines grandes marques stockent l'hydrogène
sous forme classique, avec les problèmes que l'on sait : danger
d'explosion, volume important occupé par le réservoir pressurisé,
difficultés pour faire le plein rapidement....
Les véhicules du XXIème siècle pourraient rouler à l'acide formique.
Cette solution permet un stockage de l'hydrogène, non seulement plus
sûr, mais également plus compact et plus simple à remplir à la pompe -
l'acide formique est liquide à température ambiante. Techniquement
c'est tout à fait faisable. D'ailleurs, de grands constructeurs nous
ont contactés en 2008, quand le baril de pétrole a atteint des sommets.
A mon sens, le seul obstacle est économique. Il s'écoulera encore
quelques années avant de peut-être pouvoir faire le plein à la première
fourmillière croisée sur le chemin.
Densité de l'acide formique H-COOH, par rapport à l'eau d = 1,22.
|
| .
. |
|
|
Donner trois arguments qui indiquent que l'acide formique serait plus avantageux que l'hydrogène dans les véhicules du futur.
L'acide formique est un liquide très peu inflammable.
Le procédé permet de stocker presque le double d'énergie à volume égal.
Cette
solution permet un stockage de l'hydrogène, non seulement plus sûr,
mais également plus compact et plus simple à remplir à la pompe.
Démontrer
que l'affirmation du texte " un litre d'acide formique peut libérer par
transformation chimique plus de 53 g d'hydrogène" est vraie.
HCOOH --> H2 + CO2.
Masse de un litre d'acide formique : 1,22 kg = 1220 g.
Masse molaire de l'acide formique m = 46 g/mol.
Quantité de matière d'acide formique dans 1 L : 1220 / 46 =26,5 mol.
Quantité de matière d'hydrogène : n = 23,5 mol.
Masse d'hydrogène : m = n M(H2) = 26,5 *2 = 53 g.
Compléter la chaine de conversion d'énergie et des transformations chimiques avec les termes suivants : CO2, énergie électrique, O2, HCOOH.
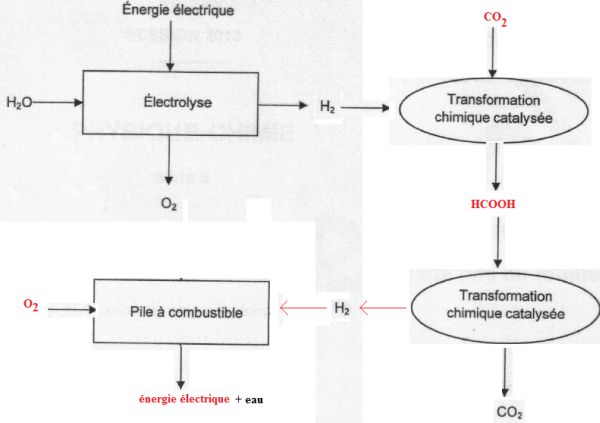
|
.
|
|
L'acide formique en milieu biologique.
Depuis très longtemps les scientifiques s'intéressent à l'acide
formique. En 1671, le naturiste anglais John Ray a isolé, par
distillation d'un grand nombre de fourmis mortes, un liquide incolore à
forte odeur âcre et au caractère acide nommé acide formique. Les
fourmis se défendent en mordant avec leurs mandibules et, pour
certaines espèces, en projetant de l'acide formique dans la morsure. La
réaction avec l'eau des tissus provoque des brûlures.
Pourquoi l'acide formique est-il un acide suivant la théorie de Brönsted ?
L'acide formique est susceptible de libérer un proton H+.
Ecrire l'équation de la réaction chimique à l'origine des brûlures.
HCOOHaq + H2O = HCOO-aq + H3O+aq.
L'estomac du tamanoir.
La
digestion des aliments dans l'estomac nécessite un milieu acide de pH
voisin de 2. Chez la plupart des mamifères ce pH est atteint grâce à la
production d'acide chlorhydrique dans l'organisme. En revanche,
l'appaeil digestif du tamanoir est différent en raison de son régime
alimentaire : il mange jusqu'à 30 000 fourmis par jour.
pKa( HCOOH / HCOO-) =3,8.
Quelle est l'espèce prédominante du couple acide formique / ion formiate dans l'estomac des tamanoires ? Justifier.
A pH voisin de 2, inférieur au pKa de ce couple, la forme acide HCOOH prédomine.
La
concentration en acide formique apporté dans l'estomac du tamanoir
est-elle égale, inférieure ou supérieur à 0,01 mol/L ? Justifier.
D'après HCOOHaq + H2O = HCOO-aq + H3O+aq, [H3O+aq]=[HCOO-aq] =10-pH = 0,01 mol/L.
pH = pKa + log ([HCOO-aq]/[HCOOHaq]) ; 2 = 3,8 + log (0,01/[HCOOHaq]).
-1,8 = log 0,01 - log [HCOOHaq] ; log [HCOOHaq] =-2+1,8 = -0,2 ; [HCOOHaq]=0,63 mol/L.
Conservation de l'élément carbone : [HCOOHaq]+[HCOO-aq] =0 ,63+0,01 = 0,64 mol/L.
Proposer
une hypothèse justifiant le fait que les tamanoirs n'ont pas besoin de
produire d'acide chlorhydrique pour leur digestion.
L'acide formique est présent dans la nourriture du tamanoir : 30 000 fourmis mangées par jour.
|
|
|