Les
alcools industriels. Bac S Liban 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Le méthanol.
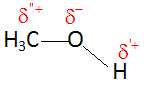
Justifier le caractère polaire de la molécule de méthanol.
Les atomes de carbone et d'hydrogène ont une électronégativité voisine.
Par contre l'atome d'oxygène est bien plus électronégatif que l'atome
de carbone.
Le
barycentre des charges partielles négatives ne coïncide pas avec le
barycentre des charges partielles positives : la molécule est donc
polaire.
Associer chacune des équations ou demi-équations suivantes à l'un des usages du méthanol.
(a) CH3OH + H2O = CO2+ 6H++ 6e-.
Oxydation du méthanol dans une pile à combustible
(b) CH3OH + CO ---> CH3CO2H.
Production d'acide acétique.
Dans la demi-équation électronique ci-dessus, le méthanol intervient-il en tant qu'oxydant ou en tant que réducteur ? Justifier.
Le méthanol cède des électrons : c'est un réducteur qui s'oxyde.
La synthèse du MTBE peut être modélisée par la réaction d'équation suivante :
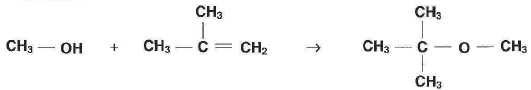
L'alcène réagissant avec le méthanol présente-t-ilune isomérie Z/E ? Justifier.
Les atomes de carbone doublement liés portent les même groupes, soit deux hydrogène soit deux groupes méthyle CH3 : cet alcène ne présente pas d'isomérie Z/E.
La recherche étudie actuellement la production de méthanol par hydrogénation du dioxyde de carbone.
Quel(s) intérêt(s) celle-ci présente-t-elle au point de vue du respect de l'environnement ?
Le
dioxyde de carbone est un gaz à effet de serre, responsable des
modifications climatiques : produire du méthanol à partir du dioxyde de
carbone atmosphérique est un moyen de diminuer sa concentration dans
l'air.
|
| .
. |
|
|
L'éthanol.
C'est un solvant miscibles avec la plupart des composés organiques.
C'est également un carburant, ajouté à l'essence en diverses
proportions selon les pays. Une grande partie de l'éthanol industriel
est produit par hydratation de l'éthène C2H4 par catalyse acide.
Ecrire l'équation chimique correspondante.
C2H4 + H2O ---> CH3CH2OH.
A quelle grande famille de réactions en chimie organique cette réaction appartient-elle ? Justifier.
Une
double liaison C=C disparaît et deux nouvelles liaisons simples sont
créées. Il s'agit donc d'une réaction d'addition sur une double liaison
éthylénique.
La première étape du mécanisme réactionnel de cette
réaction chimique consiste en une réaction entre la molécule d'éthène
et un ion hydrogène H+ provenant du catalyseur.
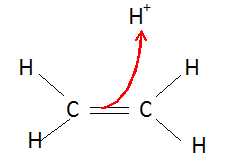
Identifier
les sites donneur et accepteur de doublet d'électrons puis représenter,
à l'aide d'une flèche courbe, le mouvement du doublet d'électrons dans
cette étape.
La double liaison C=C est le site donneur et l'ion hydrogène le site accepteur.
 Pour quelle raison, au cours d'une étape ultérieure, l'ion H+ sera-t-il régénéré ?
L'ion H+ joue le rôle de catalyseur.
|
.
|