A
propos de l'acide citrique. Bac S Polynésie 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
La molécule.
Entourer
le groupe caractéristique de la fonction alcool.
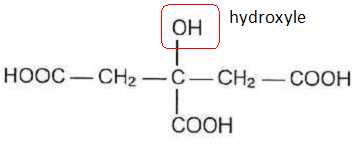
Identifier les groupes caractéristiques responsable de l'acidité et justifier le fait que l'acide citrique soit un triacide.
L'acide citrique possède trois groupes carboxyle -COOH ; c'est donc un triacide.
L'acide citrique, un détartrant.
On lit sur l'étiquette d'un sachet de détartrant :" acide citrique 100 % ; contenance 40,0 g".
Afin
de vérifier cette indication, on dissout le contenu d'un sachet dans
2,00 L d'eau distillée. On obtient la solution S. On réalise un titrage
pHmétrique d'une prise V = 10,0 mL de la solution S par une solution
aqueuse d'hydroxyde de sodium de concentration molaire cb = (1,00 ±0,02) 10-1 mol/L. L'acide citrique est noté AH3.
Equation support du titrage : AH3 aq + 3HO-aq ---> A3-aq + 3H2O(l).
Déterminer la concentration molaire d'acide citrique de la solution titrée.
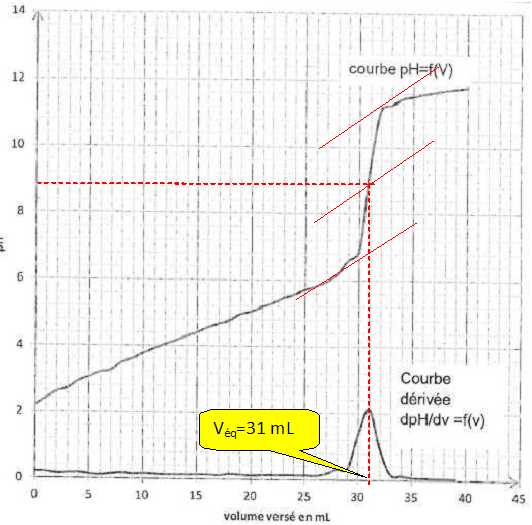
A l'équivalence : n(HO-) =3 n(AH3) ; cbVéq = 3[AH3] V ;
[AH3] = cbVéq / 3V) =0,100 *31 / 30 =0,10333 ~ 0,103 mol/L.Calculer le pourcentage en masse, noté p, d'acide citrique dans le sachet.
M(AH3) =192 g/mol.
Quantité de matière dans 2 L de S : n = 0,2067 mol ; masse d'acide citrique m = nM = 0,2067*192 =39,68 ~39,7 g
p = 39,68 /40 *100 = 99,2 %.
|
| .
. |
|
|
L'incertitude Dp sur p est donnée par la relation suivante avec DVa =DV = 0,5 % et DVéq = 1 %.
p est-il cohérent avec l'étiquette ? 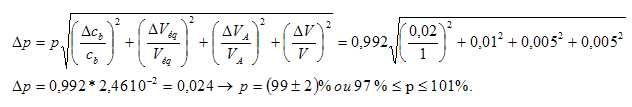
p est cohérent avec l'étiquette.
|
.
|
|
La solution de détartrant obtenue par dissolution d'un sachet contient des ions H3O+ libérés par l'acide citrique. En présence de tartre, constitué de carbonate de calcium CaCO3, il se produit une réaction chimique dont l'équation s'écrit : CaCO3(s) +2H3O+aq ---> Ca2+aq + CO2(g) +3H2O(l).
Proposer un argument pour expliquer que la solution détartrante est plus efficace lorsqu'elle est préalablement chauffée.
La température est un facteur cinétique ; la solution contient davantage d'ion H3O+aq.
Une bouilloire électrique, de puissance électrique P = 1500 W porte 0,40 L d'eau initialement à 18°C à 85°C en Dt =1 min 20 s. ceau = 4,2 kJ kg-1°C-1.
Etablir un bilan énergétique pour la bouilloire et calculer son rendement énergétique.
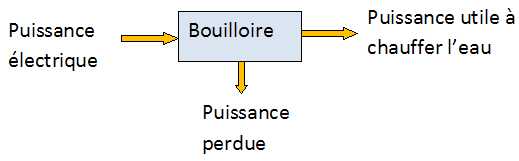
Puissance utile à chauffer l'eau : meau ceau ( qfin-qinitial) / Dt =0,40 *4,2 103 *(85-18) / (60+20) =1,4 103 W.
Rendement : Putile / Pélectrique =1,4 / 1,5 = 0,93 (93 %).
|
|
|