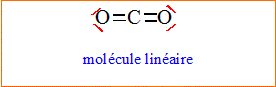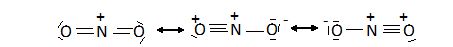Autour du dioxyde
de carbone. Bts chimiste 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
Les émissions mondiales de gaz à effet de serre ont progressé de 24 % depuis 1990. Dans le même temps, les émissions européennes ont diminué de 17,4 %. Cette évolution est mesurée sur les trois principaux gaz à effet de serre : le méthane, le dioxyde de carbone et le protoxyde d’azote (ou oxyde de diazote N2O).
Représenter le schéma de Lewis du dioxyde de carbone CO2. En déduire, grâce au modèle V.S.E.P.R., la géométrie de cette molécule.
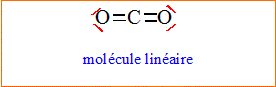 L'atome
de
carbone central est du type AX2.
Le Tableau suivant donne les distances interatomiques dans N2O, N2, et NO2+. L'atome
de
carbone central est du type AX2.
Le Tableau suivant donne les distances interatomiques dans N2O, N2, et NO2+.
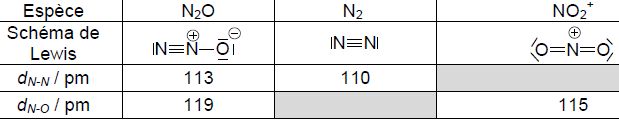
Proposer une explication pour interpréter les différences observées sur les valeurs mesurées pour dN-N et dN-O dans ces espèces.
Dans la molécule de diazote N2, on retrouve la longueur d'une triple liaison.
La
structure réelle de la molécule N2O est
représentée par une superposition des deux
formes suivantes : La
liaison entre les atomes d'azote est intermédiaire entre une liaison
double est un liaison triple ; la liaison entre l'azote et l'oxygène
est intermédiaire entre une liaison simple et une liaison double.
La
liaison entre les atomes d'azote est intermédiaire entre une liaison
double est un liaison triple ; la liaison entre l'azote et l'oxygène
est intermédiaire entre une liaison simple et une liaison double.
La
structure réelle de la molécule NO2+ est
représentée par une superposition des trois
formes suivantes :
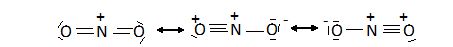
Comment capter et stocker le dioxyde de carbone émis ?
La réduction des émissions de dioxyde de carbone peut passer par un
captage puis un stockage de celui produit par l’industrie chimique.
Captage.
Actuellement, le dioxyde de carbone industriel est capté grâce à des
solvants, en phase liquide. Mais le procédé utilisé nécessite une
énergie très importante, ce qui le rend trop coûteux. Afin de diminuer
ces coûts de captage, des recherches sont menées pour piéger le dioxyde
de carbone émis dans des solides poreux, comme certains oxydes
métalliques tels que la cérine ou oxyde de cérium CeO2, qui sert
actuellement comme capteur de gaz.
L’oxyde de cérium solide possède la même structure cristalline que la fluorine CaF2. On peut considérer CeO2 comme indiqué ci-après : les ions Ce4+ forment une structure cubique à faces centrées, les ions O2- occupent la totalité des sites tétraédriques de cette structure.
Compléter la maille conventionnelle de l’oxyde de cérium.
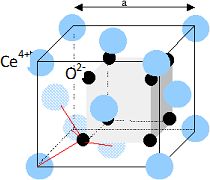
Les ions cerium sont disposés suivant un réseau cubique à faces centrées.
Les ions oxydes constituent un réseau cubique de coté ½ a qui s'intercale dans le réseau des ions cerium.
|
| .
. |
|
|
Écrire la relation de tangence entre anion et cation dans cette structure, en fonction de r+ (rayon ionique de Ce4+), r- (rayon ionique de O2-) et a, paramètre de maille.
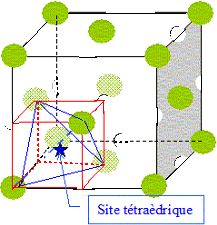
Dimension de la grande diagonale du petit cube rouge ( figure
ci-dessus) :
d2= (½a)2 + (½2½a)2 ; d = 3½
a/2 ; RCe4+ +Rtétra =½d =3½ a/4.
Déterminer la valeur numérique du paramètre de maille a.
RCe4+ = 94 pm ; Rtétra =RO2- =140 pm.
a = 4(140+94) / 3½ =540 pm
Définir la compacité C d’un cristal.
La compacité est le rapport du volume occupé par les ions au volume de la maille.
On trouve que la compacité C de la cérine est égale à 0,67.
Commenter la valeur obtenue compte tenu de l’utilisation envisagée de la cérine.
La cérine est peu compacte. Cette structure peut convenir au stockage du dioxyde de carbone.
|
|
|
Stockage géologique.
Le dioxyde de carbone capté peut ensuite être stocké par minéralisation sous forme de carbonate de calcium.
Des études sont également menées vers une minéralisation sous forme
d’oxalate de calcium : après hydrogénation du dioxyde de carbone en
acide oxalique (réaction 1), il serait possible d’injecter la solution
aqueuse d’acide oxalique dans un sol calcaire riche en carbonate de
calcium, ce qui conduirait à la formation d’oxalate de calcium
(réaction 2).
Le dioxyde de carbone libéré pourrait être piégé dans les pores du solide formé.
Réaction 1: 2 CO2(aq) + H2(g) = H2C2O4(aq)
Réaction 2: CaCO3(s) + H2C2O4(aq) = CaC2O4(s) + CO2(g) + H2O(l)
Donner la relation liant la constante d’équilibre K2 de la réaction (2) aux concentrations molaires et aux pressions partielles des réactifs et des produits.
K2 =PCO2 [H2O(l)] / [H2C2O4(aq)].
La valeur de K2 est de 2,5 x 1011 à 298 K. Commenter ce résultat.
La constante K2 étant très grande, la réaction 2 est totale dans le sens direct.
L’acide oxalique en solution peut être dosé par une solution de permanganate de potassium.
Un échantillon de volume V = 10,00 mL de solution d’acide oxalique est
dosé par une solution de permanganate de potassium de concentration C =
0,0100 mol.L-1, en milieu acide sulfurique, après addition d’un peu de sulfate de manganèse.
Écrire l’équation de la réaction support du titrage.
2 fois
{
MnO4- + 8H+ +
5e- = Mn2+ + 4 H2O
}
L'oxydant MnO4-
se réduit.
5 fois
{
H2C2O4 = 2
CO2 + 2H+ +
2e-}
Le réducteur
H2C2O4
s'oxyde.
5H2C2O4
+ 2MnO4- + 6H+ = 10
CO2 + 2Mn2++
8H2O.
Préciser le rôle de l’acide sulfurique et celui du sulfate de manganèse.
L'ion permanganate n'est oxydant qu'en milieu acide et l'ion Mn2+ est un catalyseur au début de la réaction.
Expliquer comment on peut repérer visuellement l’équivalence.
L'ion permanganate est la seule espèce colorée ( violet) ; avant
l'équivalence il est en défaut ; après l'équivalence il est en excès.
Juste après l'équivalence la coloration rose violette persiste.
Le volume versé à l’équivalence, VE, est égal à 13,0 mL.
Déterminer l’expression de la concentration d’acide oxalique C1 dans la solution étudiée, puis calculer cette concentration.
A l'équivalence, les
quantités de matière des
réactifs mis en présence sont en
proportions stoechiométriques.
2 n(H2C2O4) = 5
n(MnO4-
) ; n(MnO4-
) =0,4n(H2C2O4).
C VE =0,4 C1 V ; C1 = 2,5C VE / V =2,5 *0,0100 *13,0 / 10,00 =3,25 10-2 mol/L.
|
|
|