Une
maison à énergie positive.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
La
revue CVC n° 874 de mai / juin 2012 présente un article sur une petite
maison à énergie positive. L’idée est de coupler la production électrique
photovoltaïque à une pompe à chaleur.
Les modules photovoltaïques ne convertissent qu’une partie de l’énergie
solaire (de 5 % à 20 % suivant la technologie employée) en énergie électrique.
L’éclairement des panneaux photovoltaïques engendre une augmentation de leur
température. Une ventilation de ces panneaux permet de les refroidir. L’air ainsi évacué
préchauffe de l’eau située en haut de la toiture. Cette eau sert de source froide à
une pompe à chaleur. L’eau chaude sanitaire et l’eau permettant le chauffage de la
maison sont produites par le fonctionnement de la pompe à chaleur.
Conception de la maison.
La maison est en ossature bois. La surface habitable est de 150 m2. Sur la toiture de la face sud sont implantés 100 m2 de panneaux photovoltaïques. Le niveau de consommation énergétique de l’habitat est estimé à 45 kWh/m2/an.
Étude de la pompe à chaleur.
On étudie les transformations réversibles de 1 kg d’air, gaz considéré comme parfait. Le cycle simplifié est décrit ci-dessous.
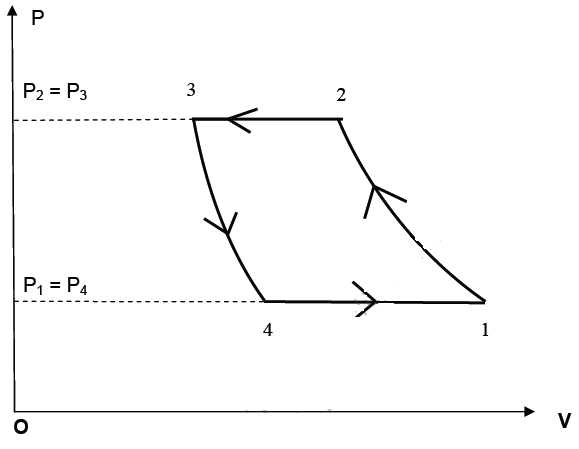
Les transformations subies sont détaillées ci-dessous :
Transformation 1-2 : l’air subit une compression adiabatique dans le compresseur faisant passer sa pression de P1 = 2×105 Pa à P2 = 6×105 Pa. La température absolue passe de la valeur T1 = 303 K à la température absolue T2.
Transformation 2-3 : dans un serpentin installé dans la réserve d’eau, l’air subit un refroidissement isobare, la température absolue passant de T2 à T3 = 323 K.
Transformation 3-4 : l’air subit ensuite une détente adiabatique ; la pression passe alors de la valeur P3 = P2 à la pression P4 = P1.
Transformation 4-1 : l’air arrive au contact de la source froide. Il se réchauffe et sa température augmente jusqu’à la valeur T1.
Constante des gaz parfaits R = 8,32 J. mol-1.K-1.
Capacité thermique massique de l’air à pression constante cp = 1,0×103 J.kg-1.K-1.
Rapport des capacités thermiques massiques de l’air, à pression constante et volume constant : g = 1,40.
Montrer que T2 = 415 K et que T4 = 236 K.
Pour une transformation adiabatique réversible, la relation de Laplace peut s’écrire : P1-g .Tg = constanteP11-g .T1g = P21-g .T2g = constante.
T2g =T1g ( P1/P2 )1-g ; T2 = T1( P1/P2 )(1-g)/g =303*(2 / 6)-0,4/1,4 =415 K.
De même : T4g =T3g ( P3/P4 )1-g ; T4 = T3( P3/P4 )(1-g)/g =323*(6 / 2)-0,4/1,4 =236 K.Calculer les différentes énergies échangées par transfert thermique au cours de chacune des transformations du cycle.
Q12 = Q34 = 0, transformations adiabatiques.
L’énergie échangée par transfert thermique avec l’extérieur par un fluide dont la température passe de la valeur T2 à la valeur T3 est donnée par la relation : Q23 = mcp m.c .(T3-T2)Q23 = 1,0 * 1,0×103 (323-415) =-9,2 104 J = -92 kJ.
De même : Q41 = 1,0 * 1,0×103 (303-236) =6,7 104 J = 67 kJ.En
utilisant le premier principe de la thermodynamique pour un cycle,
évaluer le travail fourni par la pompe à chaleur au cours du cycle.
W + Q12 + Q34 +Q23 +Q41 =0 ; W = -Q23 -Q41 =9,2 104-6,7 104 =2,5 104 J= 25 kJ Déterminer l’efficacité thermique du cycle.
L’efficacité thermique eth encore dénommé COP (coefficient de performance) d’une pompe à chaleur est donné par :
eth = |Qc/W|.
Qc : énergie fournie par transfert thermique à la source chaude.
W : énergie fournie sous forme de travail par la pompe à chaleur.
eth = -Q23 / W = 92 / 25 ~3,7.
Le bilan énergétique.
Sur une année, les 100 m2 de panneaux photovoltaïques produisent 12,5103 kWh.
Calculer la consommation énergétique annuelle.
Le niveau de consommation énergétique de l’habitat est estimé à 45 kWh/m2/an. La surface habitable est de 150 m2.
45*150 = 6,75 103 kWh.
Pourquoi cette maison est-elle qualifiée de maison à énergie positive ?
L'énergie fournie par les panneaux solaires est supérieure à l'énergie consommée par la maison.
|
| .
. |
|
|
Le système d’accumulation.
Le coefficient d’efficacité thermique réel est inférieur à celui calculé. Il sera pris égal à 3,5 dans la suite du problème.
La
pompe à chaleur permet de stocker de l’eau chaude sanitaire à 50 °C
dans un premier ballon. Les besoins en eau sanitaire sont estimés à 200
L d’eau à 50 °C par jour. En hiver, l’eau froide arrive dans le ballon
à la température de 10 °C.
Déterminer en J puis en kWh, le transfert thermique nécessaire, en hiver, pour obtenir ces 200 L d’eau à la température de 50 °C ?
Q =meau ceau Dq= 200*4,185 103 *(50-10)=3,348 107 J ou 3,348 107 /(3,6 106 )=9,3 kWh.
Déterminer
en J puis en kWh, l’énergie électrique nécessaire au fonctionnement de
cette pompe à chaleur pour obtenir cette eau sanitaire.
Q / eth = 3,348 107 / 3,5 = 9,57 106 J ou 9,57 106 / (3,6 106) =2,65~2,7 kWh.
Un
second ballon de volume V = 1000 L permet d’accumuler de l’eau chaude
servant de source de chaleur pour les besoins du chauffage. Un jour
d’hiver, la pompe à chaleur fonctionne pendant 3 heures. Sa puissance
est de 5 kW.
Calculer en J puis en kWh, l’énergie fournie par transfert thermique à la source chaude pendant cette durée de fonctionnement.
Q' = puissance (W) * durée (s) = 5 103 *3*3600 =5,4 107 J ou 5*3 = 15 kWh.
Une partie de cette énergie, soit 9,5 kWh, permet de produire l’eau sanitaire.
L’excédent permet de chauffer l’eau du second ballon.
Calculer en Joules cet excédent d’énergie.
Q" =15-9,5 = 5,5 kWh ou 5,5*3,6 106 ~2,0 107 J.
Calculer l’élévation de température de l’eau contenue dans ce deuxième ballon.
Q" = meau ceau Dq ; Dq =Q" /( meau ceau ) =2,0 107 /(1000*4,185 103) =4,7°C ; 50 +4,7 ~55 °C.
|
.
|
|
Le système de régulation.
Afin
d’améliorer le COP de la pompe à chaleur, un système de régulation
permet de faire fonctionner celle-ci lorsque la température de la
source froide est au moins égale à 20°C. Le dispositif utilisé est
schématisé ci-dessous.
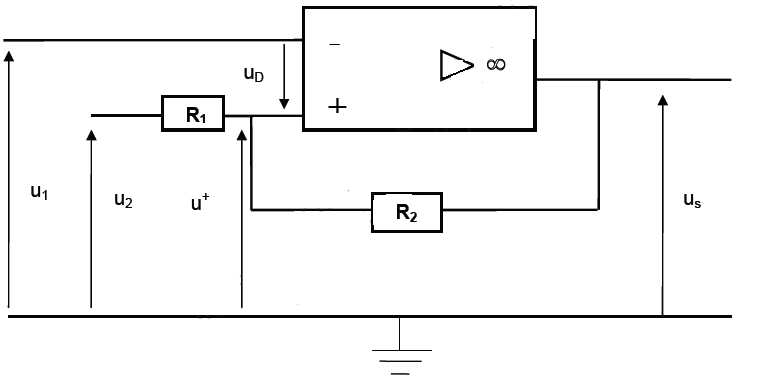
L’amplificateur opérationnel est considéré comme idéal.
u2 est une source de tension constante dont la valeur est fixée par l’opérateur. La tension u1 est délivrée par une sonde de température en contact avec la source froide telle que u1 = 0,1×θ avec θ, température de la source froide en °C. La tension de sortie us alimente un relais qui commande la fonction marche -arrêt de la pompe.
Cette dernière fonctionne lorsque us = - 14 V et est à l’arrêt lorsque us = + 14V.
Données : tensions de saturation de l’amplificateur opérationnel : +Vsat = +14 V et -Vsat = -14 V. R1 = 1 kΩ ; R2 = 18 kΩ ; u2 = 2,9 V.
u+ = 1/(R1+R2) ( R1us + R2u2).
Quel est le mode de fonctionnement de l’amplificateur opérationnel ? Justifier la réponse.
Il n'y a pas de liaison entre l'entrée inverseuse E- et la sortie de l'amplificateur ; ce dernier fonctionne en mode comparateur.
Calculer u+ lorsque us = + Vsat.
u+ = 1/(R1+R2) ( R1Vsat + R2u2) = ( 14+18*2,9) / 19 =3,48 ~3,5 V.
En début de journée, la température de la source froide est de 5°C. La pompe à chaleur est arrêtée, déterminer :
la valeur de u1 : 0,1*5 = 0,5 V.
la valeur de us : us = 14 V, la pompe étant à l'arrêt.
l’état de la pompe à chaleur : arrêt.
la valeur de u+ : 3,5 V.
Avec le soleil l’eau de la source froide se réchauffe et lors de son fonctionnement l’eau de la source froide se refroidit.
Déterminer la valeur de la tension u1
pour laquelle la pompe à chaleur entre en fonctionnement. En déduire la
température de la source froide « au déclenchement de celle-ci ».
La pompe à chaleur entre en fonctionnement dès que u1 devient supérieure à u+ ; u1 atteint donc la valeur 3,5 V et la température de l'eau vaut 3,5 / 0,1 = 35°C.
Déterminer la valeur de la tension u1 pour laquelle la pompe à chaleur s’arrête.
La pompe marche : us = -Vsat = -14 V ; u+ = ( -14+18*2,9) / 19 =2,0 V.
La pompe s'arrête dès que u1 atteint la valeur 2,0 V.
En déduire la température de la source froide à « l’arrêt de celle-ci ».
La source froide est à la température 2,0 / 0,1 = 20°C.
|
|
Analyse de l’eau sanitaire.
Dureté de l’eau.
Suivant
leur provenance, les eaux naturelles possèdent des caractéristiques
physicochimiques qui peuvent être très différentes. Une eau dure
engendre un dépôt de tartre dans les circuits de chauffage.
Les ions calcium Ca2+ et magnésium Mg2+
sont à l’origine de la dureté de l’eau. En France, la dureté d’une eau
est exprimée par son titre hydrométrique exprimé en degré hydrométrique
noté ° TH.
Un dosage a évalué les concentrations massique en ions calcium et magnésium à : Cm(Mg2+) = 29 mg/L ; Cm(Ca2+) = 82 mg/L.
Déterminer la concentration totale C en ions Ca2+ et Mg2+ de l’eau.
C = Cm(Mg2+) /M(Mg) + Cm(Ca2+) / M(Ca) = 29 / 24,4 +82/40,2 = 1,189 + 2,04 = 3,23 mmol/L.
Calculer le ° TH de cette eau. Que dire de la qualité de cette eau.
° TH = 10×C dans laquelle C est la concentration totale en ions Ca2+ et Mg2+ exprimée en mmol.L-1.
3,23 *10 = 32,3 °TH. Cette valeur étant comprise entre 15 et 35°TH, cette eau est qualifiée de dure.
Alcalinité de l’eau.
L’eau
présente un pH de 8,2. L’alcalinité de cette eau, à cette valeur de pH,
est due uniquement à la présence des ions hydrogénocarbonate HCO3-. Cette eau ne contient que les cations Ca2+ et Mg2+ et les ions hydrogénocarbonate HCO3-. Sa concentration totale en cations est de 3,3×10-3 mol.L-1.
Afin de vérifier la valeur de la concentration molaire effective en ions HCO3-, on dose cette eau à l’aide d’acide chlorhydrique composée d’ions H3O+ et Cl-.
L’équation de la réaction associée à la transformation chimique est : HCO3- (aq) + H3O+(aq) ---> CO2(g) + 2 H2O(l).
On prélève un volume V1
= 50 mL d’eau. On ajoute quelques gouttes de vert de bromocrésol. On
ajoute alors de l’acide chlorhydrique de concentration molaire C2 = 2,0×10-2 mol.L-1.
L’équivalence est obtenue pour un volume d’acide versé V2 = 16,7 mL.
Décrire l’évolution de la couleur de la solution au cours du dosage.
Zone de virage du bromocrésol : jaune 3,8 < pH < 5,4 bleu.
Avant l'équivalence, l'ion hydrogénocarbonate est en excès, le pH est supérieur à 5,4 : la solution est bleue.
Après l'équivalence, l'ion H3O+(aq) est en excès ; le pH est inférieur à 3,8 : la solution est jaune.
Déterminer la concentration [HCO3- (aq)] de l’eau.
A l'équivalence : [HCO3- (aq)] V1 =C2 V2 ; [HCO3- (aq)] =C2 V2 / V1 =2,0 10-2 *16,7 / 50 =6,68 10-3 mol/L.
En déduire le TAC de cette eau.
Le TAC d’une eau correspond au volume d’acide chlorhydrique (exprimé en mL) de concentration molaire 2,0×10-2 mol.L-1 nécessaire pour doser 100 mL d’eau.
Pour doser 100 mL d'eau, il faut 16,7*2 = 33,4 mL de solution d'acide chlorhydrique. TAC = 33,4.
|
|
|