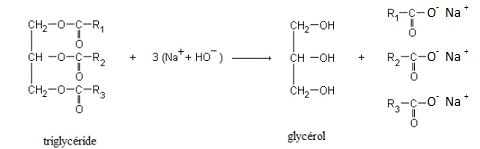
Synthèses de savons, catalyse par
transfert de phase, les liposomes.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
|
|
Synthèses de
savons.
Première synthèse.
On se propose de réaliser la synthèse d’un savon. Pour ce faire, on
cherche à élaborer un protocole de synthèse du savon à partir d’un mode
opératoire trouvé sur Internet qui permet d’obtenir des acides gras et
du glycérol à partir d’huile d’olive.
Mode opératoire :
- Peser 5 g d’huile, les placer dans un ballon ; réaliser un montage à
reflux.
- Ajouter 50 mL de solution de soude alcoolique à 40 g.L -1.
- Porter à reflux pendant 15 minutes.
- Éliminer environ 30 mL d’alcool (éthanol) par distillation simple.
- Dissoudre le concentrat dans 150 ml d’eau chaude, le mélange mousse à
l’agitation.
- Acidifier avec HCl à 12%. Contrôler au papier pH.
- Tiédir jusqu’à ce que les acides gras se séparent.
- Transvaser dans une ampoule à décanter.
- Retirer la couche aqueuse.
- Après évaporation de l’eau, on obtient 0,41 g de glycérol.
Les acides gras qui peuvent être obtenus à partir de l’huile d’olive
sont :
- l’acide palmitique C 15H 31COOH
- l’acide stéarique C 17H 35COOH
- l’acide oléique C 17H 33COOH
- l’acide linoléique C 17H 31COOH
Schématiser
les différentes étapes du mode opératoire et modéliser, par des
réactions, les transformations mises en oeuvre. Indiquer la composition
des différentes phases présentes dans chacune des étapes.
Chauffage
à reflux : 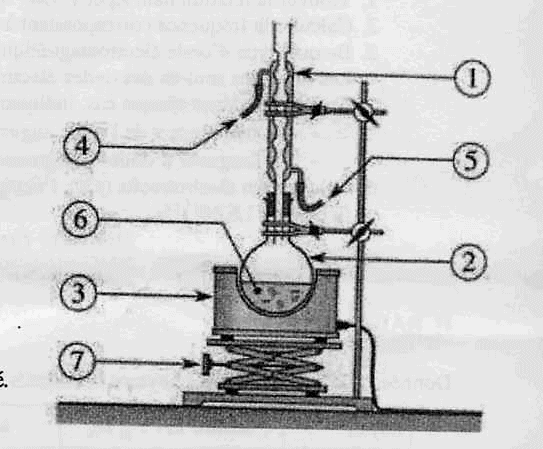
1 : réfrigérant à eau ; 2 : ballon ; 3 : chauffe ballon
; 4 : sortie de l'eau ; 5 : entrée de l'eau ; 6 : mélange réactionnel (
huile + solution de soude alcoolique ) ; 7 : élévateur à croisillons.
Distillation
simple :
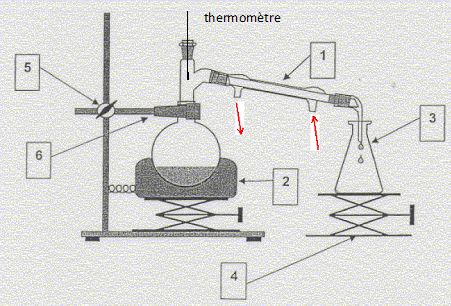
1 : réfrigérant à eau ; 2 : chauffe ballon ; 3 :
erlenmeyer ; 4 : élévateur à croisillons ; 5 et 6 : pince, noix,
potence.
Le distillat contient l'éthanol ; état final dans le ballon : glycérol,
ion carboxylate et ion sodium, éthanol résiduel, ion hydroxyde en
excès.
Ampoule à décanter
: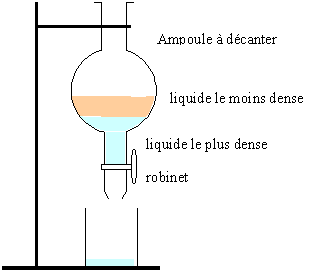
La phase inférieure contient la solution aqueuse et le glycérol ; la
phase supérieure contient les acides gras obtenus lors de l'ajout
d'acide chlorhydrique.
|
| .
. |
|
|
Deuxième
synthèse.
Dans certains protocoles de synthèse de savons, on utilise du bromure
de tétrabutylammonium, un catalyseur par transfert de phase.
Préparer une solution
aqueuse de soude en ajoutant 15 g de soude en pastilles à 50 mL d'eau
distillée. Dans un grand becher, introduire 100 g d'huile alimentaire,
puis tout en agitant au moyen de l'agitateur chauffant, ajouter
doucement la solution aqueuse de soude. Ajouter ensuite un peu de
bromure de tétrabutylammonium et agiter vigoureusement tout en
chauffant au bain marie. Au bout de quelques temps, on observe la
disparition des gouttes d'huile. Daprès chimie organique
expérimentale Hermann.
Citer
les différents types de catalyse chimique et donner des exemples issus
de l'industrie, de la vie courante et du vivant.
Catalyse homogène
: le catalyseur et les réactifs sont dans la même phase ( catalyseur de
Wilkinson dans l'hydrogénation des alcènes ; ion oxonium dans une
estérification ).
Catalyse
hétérogène : le
catalyseur et les réactifs sont dans des phases différentes ( fer lors
de la synthèse de l'ammoniac, pôt catalytique ).
Catalyse enymatique :
hydrolyse de l'amidon par l'amylase de la salive.
On
peut mettre en évidence la catalyse par transfert de phase à l'aide de
l'expérience suivante : dans deux bechers notés A et B, on introduit 50
mL d'ether diéthylique et 50 mL de solution aqueuse de permanganate de
potassium à 10-3 mol/L. Dans le becher B, on ajoute une
pointe de spatule de bromure de tétrabutylammonium ( Br-, Bu4N+).
Après quelques secondes d'agitation, on obtient le résultat suivant :

Proposer une
interprétation physico-chimique.
Les
ions sont présents en phase aqueuse : ion permanganate, ion potassium ;
l'eau. Aucune
espèces ioniques ne sont présentes dans la phase organique.
L’agent
de transfert de phase comporte une partie hydrophile
( présentant une forte affinité pour l’eau), constituée d’une paire
d’ions (ion ammonium quaternaire et ion bromure)ainsi qu'une partie
hydrophobe ( les longues chaînes carbonées ). De ce fait le bromure de
tétrabutylammonium est soluble dans l'éther.
Après
agitation, la
phase organique devient colorée" : l'ion permanganate, seule espèce
colorée, s'est donc échangé avec l'ion bromure dans la phase aqueuse.
Cet ion a été ensuite transféré, entraîné, dans la phase organique
grâce aux chaines hydrophobes du catalyseur.

|
.
|
|
Les
ethers-couronnes sont d'autres exemples de catalyseurs par transfert de
phase.
Représenter
un
éther-couronne ; justifier sa propriété de catalyseur par transfert de
phase; quel chercheur français a été récompensé par le prix Nobel pour
ses travaux sur ces molécules ?
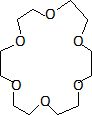
Les atomes d'oxygène situés à l'intérieur du cycle peuvent se
coordonner avec un cation. L'extérieur du cycle est hydrophobe. En
conséquence le cation complexé est soluble dans les solvants apolaires.
J.M Lehn a obtenu le prix Nobel de chimie en 1987.
On
cherche à comprendre l’action
dégraissante d’un savon.
Justifier
la place prise par le savon dans un mélange eau/huile au repos.
Le savon se place à l'interface eau-huile, tête hydrophile dans l'eau (
interaction ion dipôle ) et queue hydrophobe dans l'huile ( interaction
de London ).
Expliquer
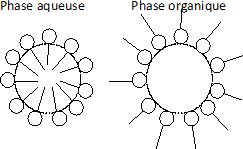
la phrase suivante : « en absence d'une des phases, les savons forment
des micelles directes dans l'eau et micelles inverses dans l'huile ».
Faire
le schéma de ces deux types de micelles et interpréter leur formation.
Micelle directe : en phas aqueuse, les tête hydrophiles sont à
l'extérieur d'une sphère et les chaînes organiques à l'intérieur. Les
interactions attractives avec le solvant sont maximales.
En phase organique, on observe l'inverse.
Proposer
une interprétation au caractère dégraissant du savon.
La micelle directe s'ouvre et se fixe sur la tache de graisse.
La partie lipophile du savon se fixe sur la tache de graisse ; la
partie hydrophile du savon est dans l'eau. Après agitation, la graisse
se détache du tissu et est entraînée dans l'eau.
Citer
et illustrer les analogies et différences entre savons et détergents.
Savons
et détergents sont amphiphiles. La tête hydrophile d'un savon (
carboxylate) est négative. La tête polaire d'un détergent peut être
neutre, cationique ou anionique.
Les savons sont obtenus par saponification et sont des agents
nettoyants. Les détergents sont obtenus à partir du pétrole ; ils sont
nettoyants et désinfectants.
Une
micelle ne se forme qu’à partir d’une concentration suffisante en
tensioactif, appelée Concentration Micellaire Critique (CMC). Au-delà
de cette concentration, le système est constitué de
micelles et de tensioactifs à la concentration micellaire critique. On
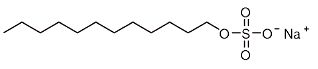
peut déterminer la CMC, à température donnée, d’un tensioactif, comme
le dodecylsulfate de sodium (noté SDS, de structure donnée ci-dessous),
par conductimétrie.
On mesure la conductivité s
de plusieurs solutions aqueuses de SDS dont les concentrations
apportées sont comprises entre 2.10-3 mol.L-1 et
2.10-2 mol.L-1.
Le graphe s = f(c) (figure
2) représente l’évolution de la conductivité en fonction de la
concentration c apportée en SDS.
Déterminer
la valeur de la concentration micellaire critique du SDS. Justifier,
par une modélisation théorique, la possibilité d’utiliser le graphe
pour obtenir cette valeur en considérant
que :
- une micelle est formée de n entités tensioactives,
- les ions Na+ sont libres en solution, que la micelle soit
formée ou non.
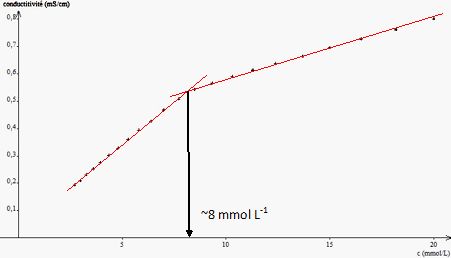
C < CMC,
absence de micelles
: s =(lSDS +lNa+) C.
C'est une droite de pente lSDS
+lNa+.
C >CMC, présence de micelles.
|
avancement
volumique
|
n
SDS
|
--->
micelle
|
initial
|
0
|
C
|
0
|
à
l'équilibre
|
x
=(C-CMC) / n
|
CMC=C-nx
|
x
|
|
|
s =(lSDS CMC+l micelle (C-CMC) / n +lNa+ C = (lSDS -l micelle /n) CMC+( l micelle /n +lNa+ )C.
C'est une droite de pente ( l micelle /n +lNa+ ).
La micelle étant moins mobile que le tensioactif libre : l micelle /n < lSDS . Une rupture de pente est
observée.
|
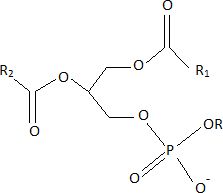
Un
phospholipide est constitué de glycérol
estérifié par des chaînes d'acides gras sur les carbones 1 et 2, le
carbone 3 portant un groupement phosphate dont l'un des oxygènes est
lié à un groupe alkyle ( -R), conduisant à un groupe -OR.
Représenter
la formule semi-développée d'un phosphoglycéride.
Schématiser
un liposome et interpréter les associations de phospholipides en
micelles et en bicouches.
Les deux
chaînes carbonées ( R1 et R2
) sont hydrophobes. Le groupe phosphate et le reste de la molécule est
hydrophile. Un liposome est une vésicule formée de deux couches
lipidiques concentriques, emprisonnant des compartiments aqueux.
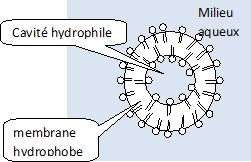
Expliquer
pourquoi un liposome peut transporter aussi bien des agents
pharmaceutiques hydrosolubles que des agents pharmaceutiques hydrophobes.
Un agent
pharmaceutique hydrophile peut se placer dans la cavité du
liposome et un médicament hydrophobe dans la membrane.
Expliquer pourquoi
le transport d'un médicament par un liposome permet d'améliorer son
efficacité.
La
structure d'un liposome est proche de celle des cellules : le
liposome peut transporter le médicament et libérer le principe actif
dans les cellules. De plus le médicament placé dans le liposome est
protégé lors de son transport ; il ne peut subir aucune altération
extérieure.
|
|
|











