Mesure de l'efficacité d'un
antioxydant :
Agrégation interne 2014.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
|
|
Première méthode : capture de l'ion superoxyde.
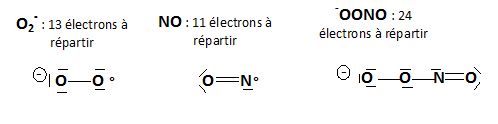
L'ion superoxyde O2- est produit par l'organisme.
Il est déruit en partie par une enzyme, la superoxyde dismutase.
Cependant, les ions échappant à cette destruction donnent lieu à la
production de radicaux libres comme HO°, à l'origine de l'oxydation des
constituants cellulaires. L'ion superoxyde peut aussi réagir avec le
monoxyde d'azote pour donner l'ion peroxynitrite -OONO qui est un agent très réactif. Il conduit également à la formation de radicaux HO°.
Proposer une structure de Lewis de l'ion superoxyde, du monoxyde d'azote et de l'anion peroxynitrite.
 On peut évaluer l'activité
antioxydante d'un composé, en étudiant la capture de l'ion superoxyde
par l'antioxydant considéré. En présence de lumière UV et de dioxygène,
le luminol L produit l'ion superoxyde selon le schéma : On peut évaluer l'activité
antioxydante d'un composé, en étudiant la capture de l'ion superoxyde
par l'antioxydant considéré. En présence de lumière UV et de dioxygène,
le luminol L produit l'ion superoxyde selon le schéma :
L + hn(UV) + O2 --->[L*O2]---> L°+ +O2-.
Le luminol réagit avec l'ion superoxyde pour former l'ion
aminophtalate. Cet ion est produit dans un état excité. Sa
désexcitation entraîne l'émission d'une radiation lumineuse de longueur
d'onde l = 351 nm.
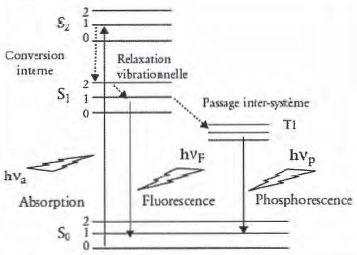
Diagramme simplifié de perrin-Jablonski.
Les états électroniques singulets sont notés S0, S1, S2 et l'état triplet T1. Les flèches en pointillés correspondent à des pertes énergétiques non radiatives.
On peut relier l'intensité If de la fluorescence à la concentration de l'espèce fluorescente : If = KI0 c.
If est l'intensité de la fluorescence, I0
l'intensité de la radiation excitatrice, c la concentration de l'espèce
fluorescente et K un facteur dépendant de la longueur de la cuve et du
coefficient d'absorption molaire entre autre. Cette relation est
valable pour les faibles concentrations.
A l'aide d'un diagramme simplifié, expliquer le principe de la fluorescence à des élèves de première S.
Les niveaux d'énergie de la matière sont quantifiés.
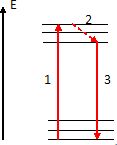
1 : la molécule dans son état de moindre énergie ( état fondamental
) absorbe un photon d'énergie h n. La molécule se trouve alors
dans un état d'énergie plus élevé ( état excité ).
La molécule à tendance à céder cette énergie supplémentaire afin de
revenir à son état fondamental. Cela se fait en deux étapes :
2 : passage à un niveau d'énergie inférieur, sans émission de radiation.
3 : passage à l'état le plus stable avec émission d'un photon d'énergie
inférieure ( donc de longueur d'onde plus grande ) à celle du photon
absorbé.
|
| .
. |
|
|
Proposer une méthode de mesure de l'activité antioxydante de l'acide pulvinique.
Génération du radical superoxyde par excitation photochimique du luminol L.
L + hn(UV) + O2 --->[L*O2]---> L°+ +O2-.
Une partie des radicaux superoxyde réagissent avec l'acide piruvique.
Les radicaux superoxyde restants sont détectés par fluorecence du luminol.
L'intensité de la fluorescence est proportionnelle à la concentration des radicaux superoxyde n'ayant pas réagi.
Pour
déterminer la constante de proportionalité K, mesurer l'intensité
fluorescente en absence d'antioxydant ou en présence d'un composé de
référence.
Rôle du luminol : formation de l'ion superoxyde et de l'ion fluorescent aminophtalate.
Deuxième méthode : capture du radical DPPH.
Cette méthode utilise le radical stable 2,2-diphényl-1-picrylhydrazyl ( DPPH. Ce dernier est réduit par un antioxydant. 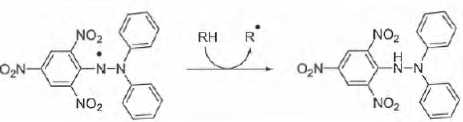
Justifier la manière dont le DDPH permet de tester l’efficacité d’un antioxydant.
Le DPPH présente un maximum d'absorption vers 517 nm ; ce radical est violet.
Après réduction par un antioxydant ce radical conduit au DPPH2, de couleur jaune, absorbant peu vers 517 nm.
Cette réduction met en jeu un seul électron. Les quantités de matière d'électrons, de DPPH2 formé et d'antioxydant ayant réagi sont égales. On note AH l'antioxydant
| Avancement volumique ( mol/L) | DPPH | +AH | =DPPH2 | +A | | initial | 0 | c | c' | 0 | 0 | | en cours | x | c-x | c'-x | x | x |
On effectue un suivi spectrophotométrique à 517 nm. L'absorbance est proportionnelle à la concentration en DPPH restante. A = l e (c-x). On en déduit l'efficacité de l'antioxydant.
Proposer une expérience quantitative utilisant cette méthode en classe de première S.
L'antioxydant utilisé est l'acide ascorbique. On réalise une courbe d'étalonnage en mettant en oeuvre la loi de Beer-Lambert.
Gamme
étalon réalisée à partir de solution d'acide ascorbique à 20,0 mmol/L,
40,0 mmol/L, 60,0 mmol/L , 80,0 mmol/L et 100 mmol/L.
Vérification
de la teneur en acide ascorbique d'une ampoule de Lascobine 1000 de 5
mL. Diluer 20 fois le contenu de cette ampoule.
Mesure de l'absorbance de toutes les olutions vers 270 nm.
Tracer la droite d'étalonnage et l'utiliser pour déterminer la teneur en acide ascorbique de l'ampoule.
|
.
|
|
Les sels de plomb dans les fards de l’Egypte ancienne : le début de la chimie.
L’analyse
des fards égyptiens témoigne de la présence de galène (sulfure de
plomb), solide noir, et d’un mélange blanchâtre composé de cérusite
(carbonate de plomb), laurionite (Pb(OH)Cl) et phosgénite (Pb2(CO3)Cl2).
Galène et cérusite sont des pigments facilement accessibles. En
revanche, la laurionite et la phosgénite sont très rares dans la
nature, en quantité trop faible pour qu’elles aient pu être intensément
utilisées comme base de cosmétique pendant une longue période. Les
égyptiens ont en fait synthétisé ces deux espèces. La méthode de
synthèse a été décrite par Dioscoride, médecin et scientifique grec ;
elle est directement transcrite des enseignements transmis par les
Grands Prêtres Egyptiens. D’après La Chimie et l’ar t- Christian
Amatore - EdP Sciences.
On se propose d’étudier la manière dont les
égyptiens, en synthétisant la laurionite, ont utilisé les lois de
modération (déplacement des équilibres chimiques) sans le savoir.
Document 1. Recette de Dioscoride.
«
Après avoir mélangé une livre d’écume d’argent (PbO) à cinq drachmes de
sel de roche (NaCl), verser de l’eau tiède, et remuer très
vigoureusement trois fois par jour (…). Laisser le mélange reposer,
éliminer l’excès d’eau, puis ajouter du sel de roche et de l’eau tiède.
Répéter l’ensemble de ces opérations trois fois par jour pendant trente
jours jusqu’à ce que la solution ait perdu toute sa causticité. »
Document 2 : Diagramme de Pourbaix des chlorures de plomb : log ([Cl-])=f(pH).
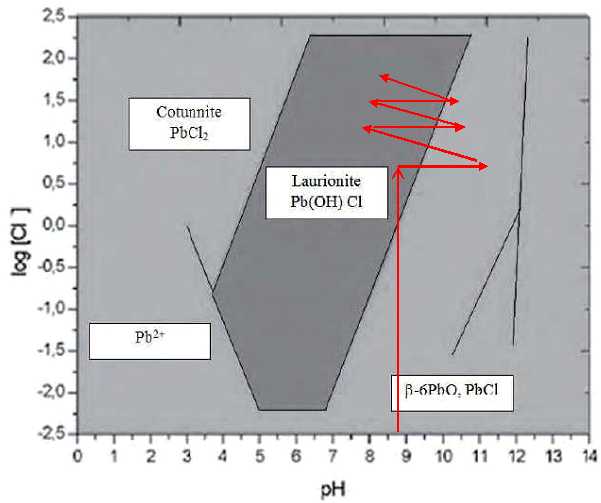
Ecrire l'équation de la réaction de synthèse de la laurionite.
PbO(s) +Cl- +H2O = Pb(OH)Cl(s) + OH-. (1)
Comment, avec les techniques actuelles, pourrait-on s'assurer que la solution a perdu toute sa causticité ?
Mesure du pH de la solution ( papier indicateur universel ou pHmètre ).
Reproduire
le diagramme et illustrer sur celui-ci l'évolution du mélange lors de
la synthèse de la laurionite selon la recette de Dioscoride.
En
mélangeant de l'oxyde de plomb pBO(s) et du chlorure de sodium, on
obtient de la laurionite et de la soude. Celle-ci nous fait sortir du
domaine de stabilité de la laurionite.
En éliminant l'excès d'eau (
on élimine les ions hydroxyde ) et en rajoutant une solution de
chlorure de sodium, le pH diminue : on repasse dans le domaine de
stabilité de la laurionite.
Expliquer en quoi la synthèse mise au point par les égyptiens illustre les lois de modération.
Constante d'équilibre de (1) : K = [HO-]éq / [Cl-]éq. Quotient de réaction Q = [HO-] / [Cl-]. Affinité chimique A = RT ln(K/Q).
A l'équilibre, A=0 : Q=K.
En éliminant l'eau ( donc HO-) et en ajoutant du chlorure de sodium ( Cl- croît ), le quotient de réaction diminue et devient inférieur à Ket A >0. L'équilibre est déplacé dans le sens direct.
La céruse : un pigment utilisé pour blanchir la peau.
La cérusite ou carbonate de plomb( 2PbCO3, Pb(OH)2
) existe naturellement. C'est un pigment blanc utilisé en peinture et
dans les cosmétiques. L'emploi du blanc de plomb comme fard est attesté
dès l'antiquité gréco-romaine. les femmes s'en enduisaient le visage et
les épaules pour masquer leur rides.
Pictogrammes de danger du plomb :
Que signifie ces trois pictogrammes et les lettres H et P ?
Nocif, irritant ; danger pour la santé ( canèrigène ) ; danger pour l'environnement.
H : dangers ; P : conseils de prudence.
Quelle maladie l'ingestion du plomb provoque-t-elle ? Pourquoi de nombreux enfants en ont été atteints ?
Le saturnisme ; la céruse ayant un goût sucré, les enfants mangent les morceaux de peinture écaillée.
Quel pigment bblanc utilise-t-on actuellement dans les peintures ?
L'oxyde de titane TiO2.
|
|






