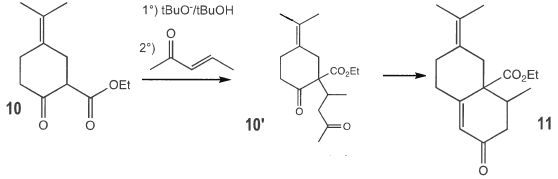
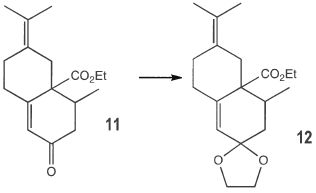
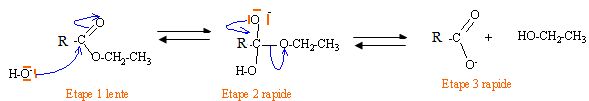|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. L'étape suivante est une
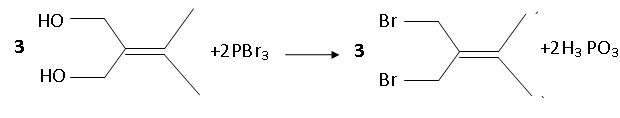
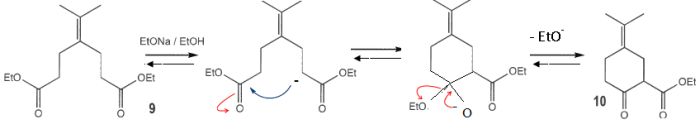
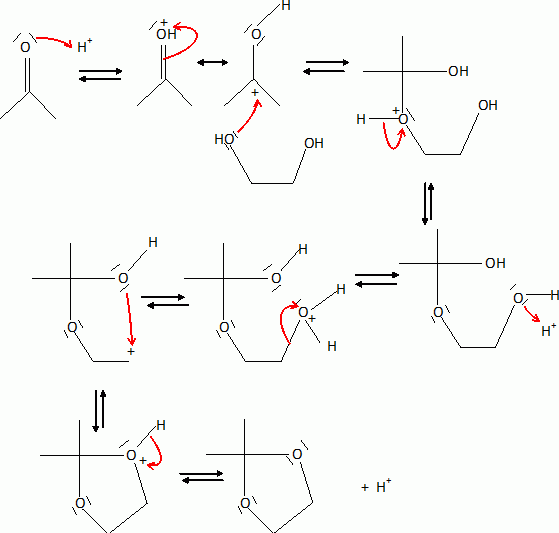
déshydratation. 3 est
plus substitué, donc plus stable, que 3' ( règle de Zaïtsev) ; 3
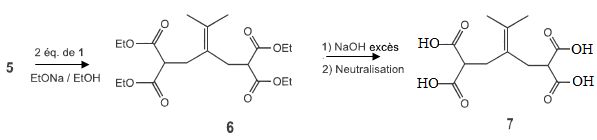
possède un système conjugué et est stabilisé par résonance. Saponification d'un ester
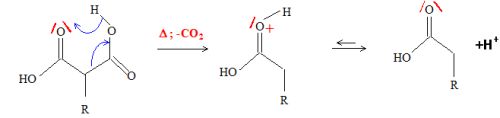
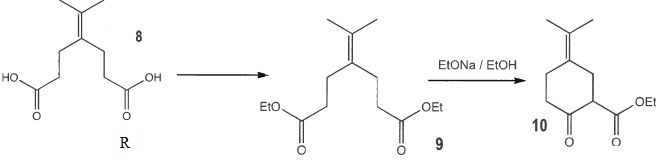
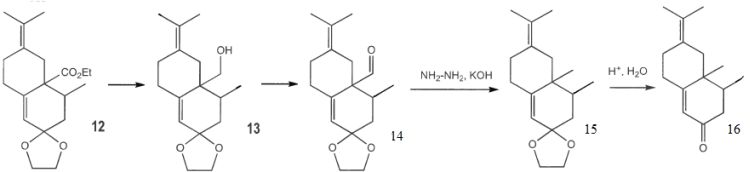
suivi d'un passage en milieu acide ( protonation de l'ion carboxylate ). Nommer la réaction qui transforme 7 en 8 et proposer un
mécanisme.
|
||||||||||||||||||||
|
|
||||||||||||||||||||
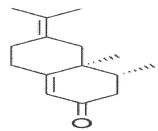
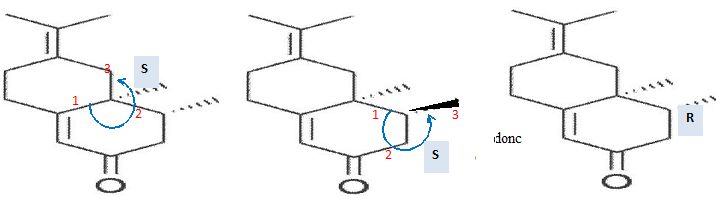
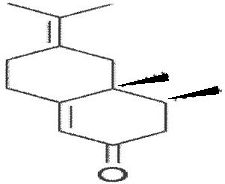
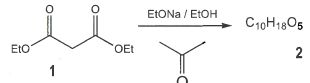

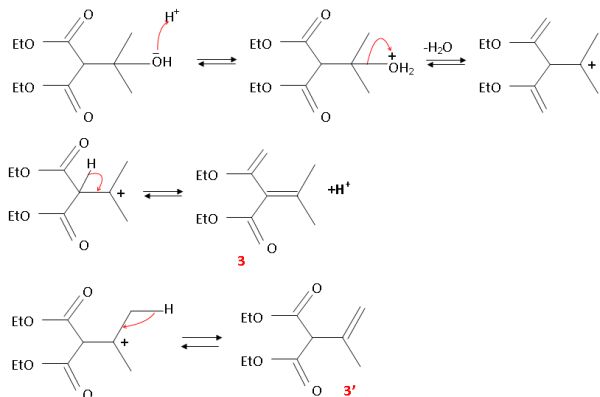
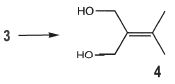 LiAlH4.
LiAlH4.